ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Молекулалық физика және термодинамика
Молекулалық физиканың негізіне заттың молекулалық құрылысы туралы болжам алынады. Бұл гипотеза бойынша зат үздіксіз және шексіз бөлінбейді. Заттың барлық қасиетін сақтайтынең кішкентай бөлшегін молекула деп атайды. Молекулалардың қозғалысы көзге көрінбейді.
Зат құрылысының алғашқы элементтеріне: зат мөлшері, мольдік масса, Авогадро саны сияқты ұғымдар біріктіріледі.
Зат мөлшері – заттың белгілі массасындағы құрылымдық элементтері санымен сипатталады. Құрылымдық, элементтеріне атомдар, молекулалар, иондар жөне т.б. бөлшектер немесе арнайы бөлшектер тобы жатуы мүмкін. СИ жүйесіндегі зат мөлшерінің өлшем бірлігі моль деп аталады. Мольдер саны
Массасы 0,012 кг 12С көміртегі изотопында қанша атом болса, сонша құрылымдық элементтеріне ие жүйедегі заттың мөлшері мольге тең деп алынады. Сондықтан, анықтамасы бойынша кез келген заттың бірлік мөлшерінде (бір мольде) құрылымдық элементтер саны бірдей. Осы санды Авогадро тұрақтысы немесе Авогадро саны деп атайды. Бұл тұрақты итальян ғалымы А.Авогадро құрметіне аталған, белгісі
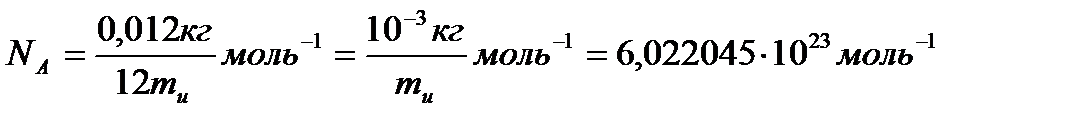 (1)
(1)Мольді өндіретін эталон болмайды, молекулалық шамалар өлшенбейді, олар есептеледі. Осы (1)-ші өрнектен мынадай анықтама шығады:
Заттың бір молінің массасын мольдік масса деп атайды. Мольдік массаны М әрпімен белгілейді. (1)-ші формуланы қолданып, мольдік масса бір молекуланың массасы мен Авогадро санының көбейтіндісіне тең болатындығын көреміз:
Егер газдың N молекуласы болса, онда мольдер саны
былай табылады:
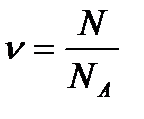 (5)
(5)Осы теңдеуді молекула массасына көбейтіп, массасы
екендігін байқаймыз, осыдан
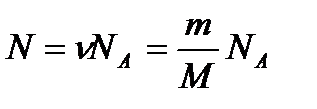 (7)
(7)болады.
Мұндай есептеулер жүргізгенде элементтердің салыстырмалы атомдық массасы Менделеевтің элементтер периодтық жүйесінен алынады.
Молекулалық физика мен термодинамикада негізінен: идеал және реал газ деп аталатын екі физикалық модельдер қолданылады.
Идеал газ:
– жеке молекуланың көлемі газ құйылған ыдыс көлеміне қарағанда ескерусіз;
– газ молекулаларының арасында өзара әсерлесу күші болмайды;
– газ молекулалары бір-бірімен және ыдыс қабырғасымен абсолютті серпімді соқтығысады.
Бұл модельді қалыпты жағдайдағы немесе өте төменгі қысыммен жоғарғы температурадағы реал газдар үшін де қолдануға болады.
Термодинамика немесе жылудың жалпы теориясы аксиоматикалық ғылым болып табылады. Ол заттың құрылымы және жылудың физикалық табиғаты жайлы ешқандай арнаулы гипотезаларды да, нақты көзқарастарды да пайдаланбайды. Оның қорытындылары тәжірибе деректерін жалпылауға негізделген принциптер мен болжамдарға сүйенеді. Ол жылуды қандай да бір ішкі қозғалыстардың жиынтығы деп қарастырады. Оның қандай қозғалыс екендігінде шаруасы болмайды. Сондықтан молекулалық физиканы зат құрылымының молекулалық-кинетикалық теориясы (МКТ) деп атайды.
Термодинамикада макроскопиялық жүйелердің күйлерін зерттеу үшін термодинамикалық және статистикалық әдістер деп аталатын екі зерттеу әдістері қолданылады.
Термодинамикалық әдіс заттың атомдық-молекулалық құрылымы туралы ешқандаймодельді көзқарастарға сүйенбейді және өзінің мәні бойынша феноменологтық (гректің рһаnоmеnоn - көрінетін, білінетін) болады. Термодинамикалық әдістің міндеті - тікелей тәжірибеде бақылайтын шамалардың (қысым, температура, көлем, концентрация және т.б.) арасындағы байланысты тағайындау. Кез келген физикалық мәселедерді шешу кезінде термодинамикалық әдісті колданғанда, онда заттың атомдық-молекулалық құрылымымен байланысты ешқандай шамалар (атом мен молекула өлшемдері, олардың массасы және т.б.) қарастырылмайды.
Термодинамиканың жалпылығы ерекше, оны қарапайым механизмдер мен адам организмін зерттеуге де қолдануға болады. Бұдан басқа, осы теорияның шеңберінде өзіміздің күнделікті өмірдегі тәжірибенің біразын түсінуге болады. Неге кеседегі ыстық шай суиды? Неге әтірдің иісі барлық бөлмеге таралады деген сияқты.
Термодинамикалық әдістің күші, оның әр түрлі заттың тікелей байқалатын қасиеттерінің арасындағы қатынастарды, олардың ішкі құрылымы туралы ештеңе білмей-ақ тағайындауда білінеді. Орасан зор сан молекулалардан құралған күрделі жүйелер туралы мәліметті, тек қана төрттен артық емес, негізгі термодинамикалық заңдар мен бірнеше айнымалы шамаларға сүйеніп алуға болады. Термодинамиканың тағы да бір артықшылығы, оның қорытындылары қарастырып отырған жүйенің өзгешелігіне тәуелді емес. Мысалы, біз тастың температурасы деп, немесе жәндіктің, немесе адамныңқолының температурасы жайында пікір айта аламыз. Тас, жәндіктің денесі, адамның қолы жылулық тепе-теңдікте болатын қасиетке ие. Заттың арнайы табиғи ерекшелігі теорияда бірнеше параметрлер арқылы белгіленеді, мысалы жылусыйымдылық, мольдік көлем деген сияқты. Осы әдіс негізінде екі әр түрлі күйдегі жүйелердің қасиеттері туралы мәліметтер алуға мүмкіндік шығады.
Тепе-теңдік термодинамикасы жүйені тыныштықкүйінде бейнелейді, оны көрнекі түрде былай сипаттауға болады "осында және қазір", ол жүйенің бұрынғы жайтын және алғашқы күйден соңғы күйге өту жолын ескермейді.
Статистикалық әдіс термодинамикалық әдіске қарама-қарсы, ол бастан макроскоптық жүйелердің қасиеттерін зерттегенде модельдік атомдық-молекулалық көзқарастарға негізделген. Статистикалық әдістің мақсатын былай тұжырымдауға болады: заттың макроскоптық мөлшерінің қасиеттерінің өзгерісі заңын тағайындау үшін, оның құрамындағы бөлшектердің (молекула, атом, ион және т.б.) қозғалыс заңдарын білу қажет. Сондықтан статистикалық физика термодинамика заңдарының теориялық дәлелдеуін атомдық-молекулалық тұрғыдан көрсетеді.
Жалпы жағдайда осы екі әдіс бір-біріне ұштасып, бірлестірілген статистикалық термодинамика әдісін құрастырады.
Молекулалық физиканың дамуының өте маңызды кезеңі кинетикалық теориямен байланысты. Кинетикалық деген ұғым қозғалысқа қатысы бар дегенді білдіреді, сондықтан құбылыстарды зерттеу үшін, олардың динамикалық сипаттарға қатысты екенін көрсетеді. Жылудың кинетикалық теориясы бойынша молекулалар шапшаң немесе баяу қозғалады, егер олар құрамына кіретін дене ыстығырақ немесе суығырақ болса. Жылулық энергиясы дененің шындығында оның құрамындағы көзге көрінбейтін молекулалық қозғалыстың денеге қатысты тұтас механикалық (кинетикалық және потенциалдық) энергиясы болып келеді. Осы түсінік бойынша жылулық энергия құрамына молекулалардың ілгерілемелі қозғалысының кинетикалық энергиясы және молекула құрылымындағы атомдардың айналмалы кинетикалық энергиясы мен тербелісінің кинетикалық және потенциалдық энергиясы кіреді. Осыдан, “молекулалардың жылулық қозғалысы” деген термин (латынның
terminus - ғылымда қолданатын белгілі ұғымды дәл белгілейтін сөз) шығады.
Молекулалық гипотеза мен жылулық кинетикалық теориясы заттың кез келген күйіне қолданылады. Заттың үш агрегаттық (латынның aggrego - қосыламын) күйлері – қатты, сұйық және газ тәріздес молекулалардың жақындық дәрежесі мен қозғалыстарының қарқындылығымен айырылады. Қатты денеде бөлшектер бір-бірімен тығыз жанасады, сондықтан өте сирек жағдайда олардың кейбіреуі көршілері арасымен сырғанап орын ауыстыруы мүмкін. Қатты денені қыздырғанда молекулалар қозғалысы үдейді, ол дененің жылулық ұлғаюына әкеледі. Бір мезгілде сыртқы қысымға байланысты бір-біріне тығыз жабысқан молекулаға бір топтан екінші топқа ауысуына мүмкіншілік туады. Осы жағдай заттың сұйық күйгеауысуына мүмкіндік береді, одан арғы қыздыру молекулалардың өзара байланыс күшін үзіп, оларға еркін қозғалуға мүмкіншілік туғызады, сондықтан молекулалар кез келген қолайлы кеңістікті жайлайды; зат газ тәріздес күйге ауысады.
Қысым мен температураның бір мәндерінде заттың екі фазасы (сұйық пен газ, қатты мен сұйық немесе қатты мен газ тәріздес) бірге қатар тепе-теңдік күйде бола, өмір сүре бастайды. Тек бір белгілі қысым мен температура мәнінде заттың барлық үш фазасы бірте тепе-теңдік күйде катар өмір сүре алады. Күй диаграммасындағы осы нүктені үштік нүкте деп атайды.
Газдың тығыздығы сұйық немесе қатты күйдегі заттың тығыздығымен салыстырғанда кіші болады. Сондықтан газдың молекулаларының арақашықтығы, олардың өлшемдерінен әлдеқайда үлкен. Қозғалыстағы молекулалар бір-біріне әлсіз әсер етеді, тек жакындасқанда жолдары алғашқы бағыттарынан елеулі ауытқуы мүмкін. Бұл жағдайда молекулалар бір-бірімен соқтығысты дейді.
Сонымен, молекула-кинетикалық теория заттың күйлерін және ондағы байқалатын құбылыстарды молекулалар арасында әсер ететін күштермен байланыстырады. Молекулааралық күштердің табиғаты эксперименттік зерттеулер мен теориялық болжаулар нәтижесі арқылы айқындалады. Мысалы, газдардың сұйыққа айналуы, үлкен қашықтықтарда молекулалар арасында тартылыс күштері, ал сұйықтың сығылуға қатты карсылығы, жақын қашықтықта тебу күштері болатынын дәлелдейді және қашықтыққа қатысты бұл күштер қатты өзгереді.
Молекулааралық күштерді жақыннан әрекеттесу және алыстан әрекеттесу деген екі топқа бөледі. Жақыннан әрекеттесу күштерін валенттік күштер немесе химиялық күштер деп те атайды. Молекулалар соншалықты жақындасқанда, тіпті олардың сыртқы электрондық бұлттары бүркелген кезде, тебу күштері пайда болады. Молекулалық өлшемдерінен үлкен қашықтықта молекулалар бірін-бірі тарта бастайды, демек тартылыс күштер пайда болады.
Молекулалық физика мен термодинамикада өте көп молекулалардан тұратын жүйе қасиеттері зерттеледі.
Термодинамикалық жүйе деп өзара және сыртқы қоршаған ортамен энергия және масса алмасуға қабілетті денені немесе денелер жиынтығын айтады.
Кез келген материялық дене орасан көп микробөлшектерден және молекулалардың үлкен жиынтығынан тұрады. Мұндай денелерді макроскоптық жүйе дейді. Макроскоптық жүйелердің өлшемдері әрқашан да атом мен молекула өлшемдерінен едәуір үлкен.
Термодинамикалық жүйені сипаттайтын барлық макроскоптық белгілерін макроскоптық параметрлер деп атайды. Оларға, мысалы тығыздық, көлем, қысым, концентрация және т.б. жатады.
Макроскоптық параметрлер сыртқы және ішкі болып бөлінеді. Қарастырып отырған жүйеге кірмейтін сырттағы денелердің макро- сипаттары сыртқы параметрлерге жатады.
Термодинамикалық жүйенің күйін тәуелсіз макроскоптық параметрлер жиынтығы анықтайды. Жүйенің бұрынғы өткен жайттарына тәуелсіз және тап осы кездегі күйін толық анықтайтын шамаларды күй функциялары дейді.
Егер жүйенің параметрлері уақыт бойынша өзгермесе, оның күйін
стационарлық деп атайды.
Сонымен, жүйенің термодинамикалық күйін, оның барлық қасиеттерінің жиынтығы анықтайды.
Термодинамикалық жүйе деп термодинамикалық тепе-теңдік күйде болатын макрожүйелерді айтады. Тепе-теңдік күйдегі жүйені сипаттайтын шамаларды P, V, T термодинамикалық параметрлер деп атайды.
Жүйенің бір күйден екінші күйге өтуі, жүйенің тепе-теңдік күйден шығуымен байланысты болады. Демек, жүйе қандай да бір жүрген кезде тепе-теңдік емес күйлерінің тізбегінен өтеді.
Тепе-теңдік күйлердің үздіксіз тізбегінен құрылған тепе-теңдік деп аталады. Тепе-теңдік кезінде жүйенің барлық макропараметрлері өте баяу, физикалық шектеусіз баяу, болымсыз өзгереді, әр түрлі нүктелеріндегі параметрлердің мәні, мысалы қысым болса, қайсыбір орташа
Егер тепе-теңдік күйінен жүйе шығарылып және еркіне жіберілсе, онда ол біраз уакыттан кейін қайтадан тепе-теңдік күйіне оралады. Жүйенің тепе-теңдіксіз күйінен тепе-теңдік күйіне өту процесі релаксация деп аталады, aл жүйенің тепе-теңдік күйге оралу уақытын релаксация уақыты дейді.
Термодинамикалық жүйеде өтетін процестің жылдамдығы релаксация жылдамдығынан едәуір кіші делік, онда бұл процестің кез келген кезеңінде барлық параметрлер мәндері теңеліп үлгереді. Сондықтан мұндай бір-біріне шексіз жақын тепе-теңдік күйлердің тізбегінен тұрады. Осындай жеткілікті баяу процестерді

