Файл: Исследование 1 Для удобства последующих расчетов составляем таблицу исходных данных, используя справочный материал.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 13
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное
Учреждение высшего профессионального образования
«Магнитогорский государственный технический университет им. Г.И. Носова»
Кафедра физической химии и химической технологии
РАСЧЁТНО-ГРАФИЧЕСКАЯ РАБОТА
По курсу «Физическая химия»
Раздел «Термодинамический анализ химических реакций»
Вариант 1.5
Выполнила: Мухина В.В.
Студент группы: МХб-20-1
(подпись)
Проверил:
(подпись)
Магнитогорск
2021
Формулировка задания
Исследование 1
Для удобства последующих расчетов составляем таблицу исходных данных, используя справочный материал.
Таблица 1
Исходные данные для термодинамического расчета реакции
Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
| Вещество | ΔНо298, кДж/моль | ΔSо298, Дж/мольК | Коэффициенты в уравнение а + bT+cT-2 , Дж/мольК | ||
| a | b *10-3 | c *10-5 | |||
| Nb2O5 | -1905,80 | 137,80 | 91,61 | 118,10 | 0 |
| H2 | 0 | 130,60 | 27,28 | 3,26 | 0,50 |
| NbO | -406,00 | 50,0 | 40,20 | 18,40 | 0 |
| H2O | -241,84 | 188,74 | 30,0 | 10,71 | 0,33 |
1.1 . Расчет изменения изобарной теплоемкости (
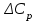 ) и теплового эффекта реакции (
) и теплового эффекта реакции (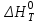 )
)Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
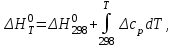 (1)
(1) где:
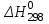 – стандартный тепловой эффект реакции при 298 К;
– стандартный тепловой эффект реакции при 298 К; - изменение теплоёмкости системы в результате протекания реакции.
- изменение теплоёмкости системы в результате протекания реакции. Последняя величина рассчитывается по уравнению:
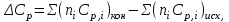 (2)
(2)где
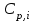 - мольная изобарная теплоёмкость i-го вещества, определяемая из уравнения:
- мольная изобарная теплоёмкость i-го вещества, определяемая из уравнения: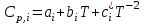 (3)
(3)Рассчитаем
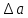 :
: 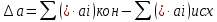 ;
;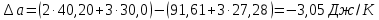 Рассчитаем
Рассчитаем 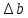 :
: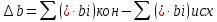 ;
;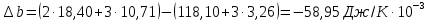
Рассчитаем
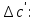
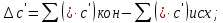
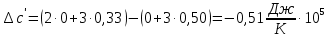
Найдем
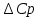 :
: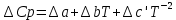
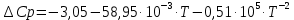 Температурный интервал 1750-2000
Температурный интервал 1750-2000 с шагом: 50
При Т=1750:
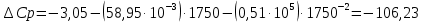 Остальные
Остальные 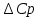 при различных температурах рассчитывается аналогично.
при различных температурах рассчитывается аналогично.Рассчитаем значения
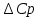 при различных температурах и сведем эти значения в табл.2.
при различных температурах и сведем эти значения в табл.2.Таблица 2
| T,K | 1750 | 1800 | 1850 | 1900 | 1950 | 2000 |
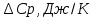 | -106,23 | -109,17 | -112,12 | -115,07 | -118,01 | -120,9 |
Зависимость изменения изобарной теплоемкости от температуры для реакции
Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
По данным табл.2. построить зависимость
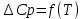 .
. 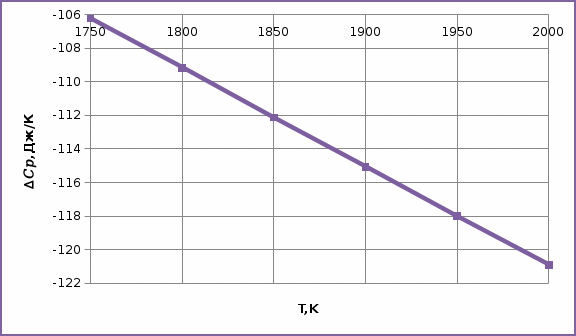
Рис.1. Зависимость изменения изобарной теплоемкости от температуры для реакции Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
Значение Н298 в уравнении (1) определяется по стандартным теплотам образования Н298, i
Н298 = (ni Н298, i )кон - (ni Н298, i)исх. (4)
В рассматриваемом случае уравнение (4) имеет вид:
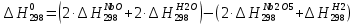 (5)
(5)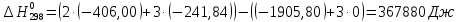 В соответствии с заданием необходимо рассчитать тепловые эффекты в интервале температур 1750-2000К при шаге температуры 50К. Получим уравнение зависимости теплового эффекта реакции от температуры:
В соответствии с заданием необходимо рассчитать тепловые эффекты в интервале температур 1750-2000К при шаге температуры 50К. Получим уравнение зависимости теплового эффекта реакции от температуры: 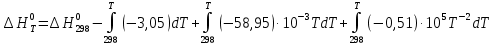
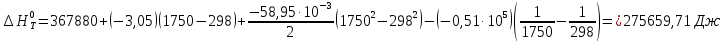
Остальные значения
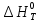 при различных температурах T=1750-2000 рассчитываются аналогично.
при различных температурах T=1750-2000 рассчитываются аналогично.Таблица 3
Величина
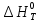 при различных температурах для реакции
при различных температурах для реакцииNb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
| T,K | 1750 | 1800 | 1850 | 1900 | 1950 | 2000 |
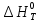 , кДж , кДж | 275659,71 | 2700274,59 | 264742,13 | 259062,3 | 253235,2 | 247260,75 |
Зависимость
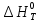 =f(T), построенная по данным табл.3 представлена на рис.2.
=f(T), построенная по данным табл.3 представлена на рис.2. 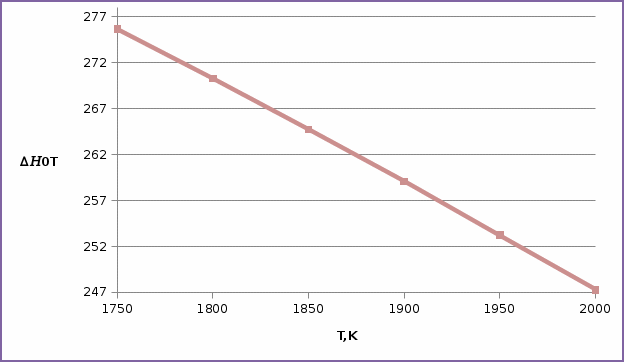
Рис.2. Зависимость теплового эффекта от температуры для реакции
Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
1.2Расчёт изменения энтропии реакции
Изменение энтропии системы в результате протекания процесса определяется по уравнению:
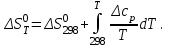 (6)
(6)В этом уравнении
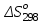 – стандартное изменение энтропии для реакции при 298К, определяемое по мольным стандартным энтропиям веществ
– стандартное изменение энтропии для реакции при 298К, определяемое по мольным стандартным энтропиям веществ 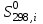 :
: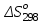 = (ni
= (ni 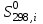 )кон - (ni
)кон - (ni 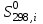 )исх (7)
)исх (7)Значения
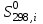 для соответствующих веществ приведены в табл. 1, после их подстановки в уравнение (7) получим:
для соответствующих веществ приведены в табл. 1, после их подстановки в уравнение (7) получим: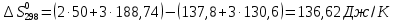
Выведем расчетное уравнение изменения энтропии от температуры:
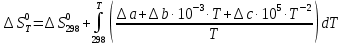
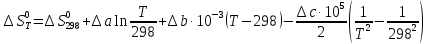 , (8)
, (8)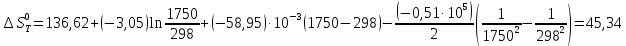
 Остальные значения
Остальные значения 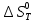 при различных температурах T=1750-2000 рассчитываются аналогично.
при различных температурах T=1750-2000 рассчитываются аналогично.Таблица 4
Значения изменения энтропии (
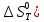 при различных температурах для реакции
при различных температурах для реакцииNb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
| T,K | 1750 | 1800 | 1850 | 1900 | 1950 | 2000 |
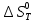 , Дж/К , Дж/К | 45,34 | 42,31 | 39,28 | 36,25 | 33,2 | 30,2 |
По данным табл.4 построим график
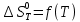 .
.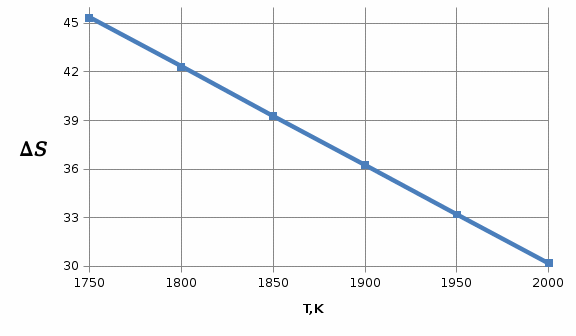
Рис.3. Зависимость изменения энтропии от температуры для реакции
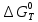
1.3. Расчет изменения стандартной энергии Гиббса
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса-Гельмгольца.
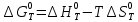 , (9)
, (9) Найденные величины изменения стандартной энергии Гиббса приведены в табл.5, по данным которой построена зависимость
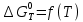 , изображенная на рис.4.
, изображенная на рис.4. 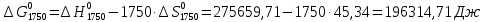 Остальные значения
Остальные значения  при различных температурах T=1750-2000 рассчитываются аналогично.
при различных температурах T=1750-2000 рассчитываются аналогично.Таблица 5
Значения изменения стандартной энергии Гиббса (
 ) при различных температурах для реакции
) при различных температурах для реакцииNb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
| T,K | 1750 | 1800 | 1850 | 1900 | 1950 | 2000 |
 , кДж , кДж | 196,31 | 194,11 | 192,07 | 190,18 | 188,49 | 186,86 |
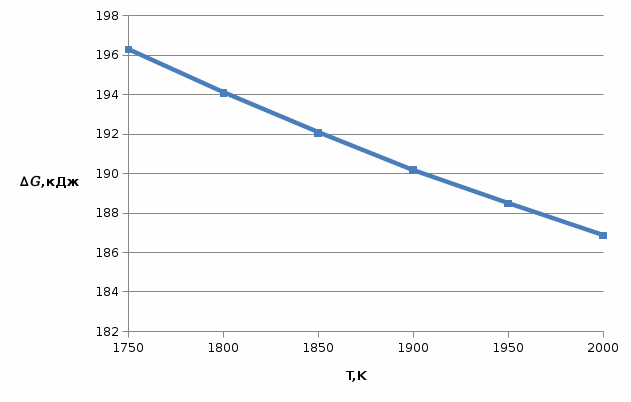
Рис.4. Зависимость изменения стандартной энергии Гиббса от температуры для реакции
Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
1.4. Вывод уравнения зависимости константы равновесия от температуры
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением:
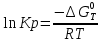 (10)
(10)После подстановки выражения (13) в уравнение (14) получим:
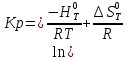 (11)
(11)Можно полагать, что в сравнительно небольшом интервале температур тепловой эффект реакции (
 ) и изменение энтропии (
) и изменение энтропии ( практически постоянные величины (это подтверждают и результаты табл.3 и 4). Отсюда уравнение можно записать в виде:
практически постоянные величины (это подтверждают и результаты табл.3 и 4). Отсюда уравнение можно записать в виде: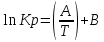 (12) ,
(12) , где A и B-постоянные, которые соответственно равны:
