Файл: Исследование 1 Для удобства последующих расчетов составляем таблицу исходных данных, используя справочный материал.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 14
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
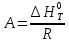 (13)
(13)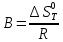 (14)
(14) Уравнение (12) отвечает линейной зависимости
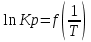 .
. Определим коэффициенты A и B графически. С этой целью по уравнению (10) и данным табл.5 рассчитаем величину
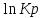 в заданном интервале температур.
в заданном интервале температур. 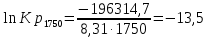
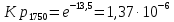
Таблица 6
Константы равновесия для реакции Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ) при различных температурах
| Т,К | 1750 | 1800 | 1850 | 1900 | 1950 | 2000 |
| 10-3/Т,К-1 | 0,57 | 0,55 | 0,54 | 0,526 | 0,51 | 0,5 |
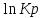 | -13,5 | -12,9 | -12,5 | -12,04 | -11,6 | -11,2 |
| Kp | 1,37·10-6 | 2,31·10-6 | 3,74·10-6 | 5,87·10-6 | 8,87·10-6 | 1,3·10-5 |
Для графического определения констант A и B в уравнении (12) по данным таблицы 6 построим зависимость
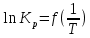 .
. 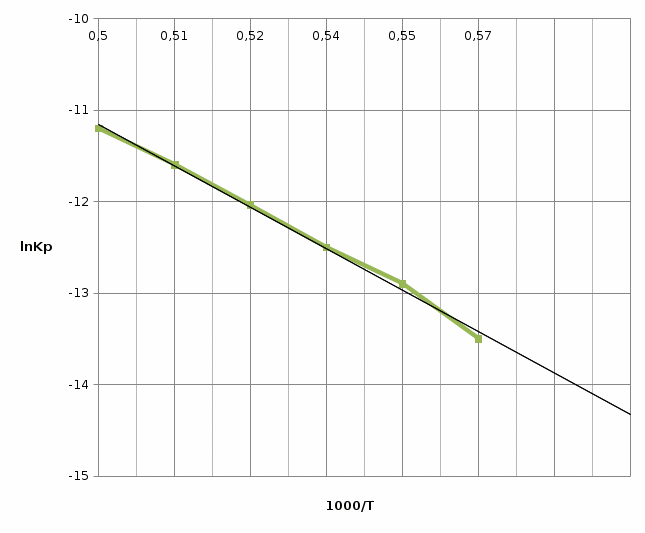 Рис.5. Зависимость lnKp от обратной температуры для реакции
Рис.5. Зависимость lnKp от обратной температуры для реакцииNb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
Рассчитаем коэффициент A
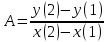
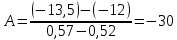
По значению коэффициента A рассчитаем величину среднего теплового эффекта
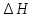 :
: 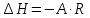
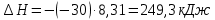
Рассчитаем коэффициент B
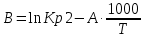
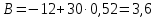
По значению коэффициента B рассчитаем величину изменения энтропии
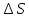 :
: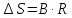
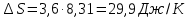
Полученные данные отлично согласуются с данными, приведенными в табл.2 и 3.
Исследование 2.
2.1 Определение количества фаз, независимых компонентов и степени свободы.
Рассматриваемая система состоит из трех фаз: двух твердых фаз Nb2O5 и NbO, а также газообразной, представляющей смесь газов H2 и H2O. Таким образом, ф=3.
Число независимых компонентов k равно наименьшему числу веществ, необходимых для выражения состава всех фаз системы. Это число определяют как общее число веществ в системе m за вычетом числа связей между ними r. Связь между веществами, входящими в рассматриваемую систему, выражается уравнением реакции.
Следовательно:
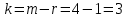 (15)
(15)Число степеней свободы c равно числу независимых переменных системы (давление, температуры, концентрации компонентов), которые можно изменить в некоторых пределах так, чтобы число и природа фаз оставались прежними. По правилу фаз Гиббса:
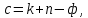 (16)
(16) Где n- число внешних параметров, влияющих на состояние равновесия системы. В нашем случае n=1 (только температура, так как в нашем уравнении давление не влияет на состояние равновесия).
Для рассматриваемой системы:
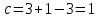
Вывод: c=1 это означает, что не нарушая состояния равновесия в известных пределах можно изменить 1 параметр, при этом число природы фаз не изменится.
2.2. Определение возможного направления.
Изотерма Вант-Гоффа
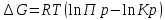
Pобщ=202,6 кПа
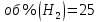
Т=1700 К
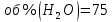
ПP- произведение фактического парциального давления газообразных компонентов
Кр- константа равновесия
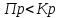
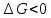
равновесие смещается в сторону продуктов реакции
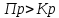
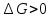 равновесие смещается в сторону исходных веществ
равновесие смещается в сторону исходных веществРассчитаем Кр при заданной Т
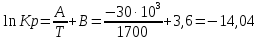
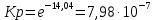
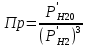
 P’H2O, P’H2 – фактические Пр, выраженные в относительных единицах.
P’H2O, P’H2 – фактические Пр, выраженные в относительных единицах.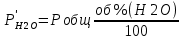
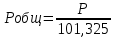
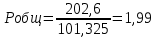
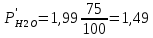
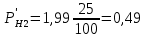
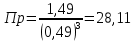

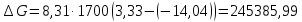
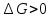 следовательно, равновесие смещается в сторону исходных веществ.
следовательно, равновесие смещается в сторону исходных веществ.2.3. Определение равновесного состояния состава газовой смеси
Nb2O5(тв) + 3H2(газ) = 2NbO + 3H2O(газ)
Обозначим через x мольную долю H2 , тогда мольная доля H2O будет 1-x
Запишем Kp для данной реакции при заданной T
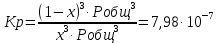

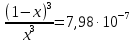 x1=0,99
x1=0,99x2=1,0045
x3=1,004
Физический смысл имеет только первый корень, т.к. мольная доля не может быть отрицательной и больше единицы. Таким образом, в равновесной газовой смеси мольная доля водорода NH2=0,99 и мольная доля воды NH2O=1-0,99=0,01. Содержание этих газов, выраженное в объемных процентах (Об.%) составит:
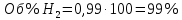
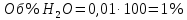
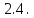 Установление направления смещения равновесия.
Установление направления смещения равновесия.Принцип Ле Шателье
1) При увеличении T равновесие смещается в сторону эндотермической реакции
Так как
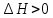 реакция эндотермическая.Следовательно, равновесие смещается в сторону продуктов реакции(вправо).
реакция эндотермическая.Следовательно, равновесие смещается в сторону продуктов реакции(вправо).2) При увеличении P равновесие смещается в сторону веществ с меньшим объемом газовой фазы. В нашем случае давление не влияет на состояние равновесия.
