Файл: Методические указания и контрольные задания для студентовзаочников для специальностей.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Таблица выбора вариантов согласно шифру
| последняя цифра предпослед цифра | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 1 |
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 1 | 2 |
| 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 1 | 2 | 3 |
| 4 | 5 | 6 | 7 | 8 | 9 | 10 | 1 | 2 | 3 | 4 |
| 5 | 6 | 7 | 8 | 9 | 10 | 1 | 2 | 3 | 4 | 5 |
| 6 | 7 | 8 | 9 | 10 | 1 | 2 | 3 | 4 | 5 | 6 |
| 7 | 8 | 9 | 10 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
Варианты заданий для контрольной работы
| № варианта | Номера заданий |
| 1 | 1,11,21,31,41,51,61,71,81,91,101,111 |
| 2 | 2,12,22,32,42,52,62,72,82, 92,102,112 |
| 3 | 3,13,23,33,43,53,63,73,83, 93,103,113 |
| 4 | 4,14,24,34,44,54,64,74,84, 94,104,114 |
| 5 | 5,15,25,35,45,55,65,75,85, 95,105,115 |
| 6 | 6,16,26,36,46,56,66,76,86, 96,106,116 |
| 7 | 7,17,27,37,47,57,67,77,87, 97,107,117 |
| 8 | 8,18,28,38,48,58,68,78,88, 98,108,118 |
| 9 | 9,19,29,39,49,59,69,79,89, 99,109,119 |
| 10 | 10,20,30,40,50,60,70,80,90, 100,110,120 |
Методические указания по выполнению упражнений и решению задач
Задача:
Пользуясь Периодической системой химических элементов, дайте характеристику химическому элементу с порядковым номером 30 по плану:
-
Порядковый номер химического элемента. -
Символ химического элемента. -
Номер периода. -
Номер группы. -
Подгруппа (главная, побочная). -
Атомная масса. -
Количество энергетических уровней. -
Электронная схема и электронная формула атома. -
Количество электронов на внешнем энергетическом уровне. -
Количество протонов. -
Количество электронов. -
Количество нейтронов. -
Формула высшего оксида.
Решение:
| Порядковый номер элемента | 30 |
| Символ химического элемента | Zn |
| Период | 4 |
| Группа | 2 |
| Подгруппа | Побочная |
| Атомная масса элемента | 65 |
| Количество энергетических уровней | 4 |
| Схема строения атома Электронная формула атома |    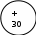  2 8 18 2 1S22S2P63S2P6d104S2 |
| Количество электронов на внешнем энергетическом уровне | 2 |
| Количество протонов | 30 |
| Количество электронов | 30 |
| Количество нейтронов | 65-30=35 |
| Формула высшего оксида | ZnO |
Задача: По названию химических соединений составьте химические формулы веществ, напишите возможные уравнения диссоциации и рассчитайте их молекулярный вес:
Оксид кальция, гидроксид натрия, сульфат калия.
Решение:
Оксид кальция СаО
Мr (CaO) = 40 + 16 = 56 (а.е.м.);
Гидроксид натрия NaOН
NaOН → Na+ + OН-
Mr (NaOН) = 23 + 16 + 1 = 40 (а.е.м.);
Сульфат калия K2SO4
K2SO4 → 2К+ + SO42-
Mr (K2SO4) = 39 х 2 + 32 + 16 х 4 = 174 (а.е.м.).
Задание:
Напишите уравнения полной диссоциации в водных растворах следующих электролитов:
А)HNO3
Б)NaOH,
В) Mg(NO3)2
Решение:
А)HNO3→ H+ + NO3-
Б) NaOH → Na+ + OH-
В)Mg(NO3)2 → Mg+2 + 2NO3-
Задание:
Напишите уравнения реакций в молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной формах:
А)хлорид железа(II) + гидроксид калия
Б)сульфит цинка + азотная кислота
В)нитрат свинца(II) + сульфат натрия
Решение:
А) FeCl2 + 2KOH → 2KCl + Fe(OH)2
Fe+2 + 2Cl- + 2K+ + 2OH- → 2K+ + 2Cl- + Fe(OH)2
Fe+2 + 2OH- → Fe(OH)2
Б) ZnSO3 + 2HNO3 → Zn(NO3)2 + H2O + SO2
Zn+2 + SO32- + 2H+ + 2NO3- → Zn+2 + 2NO3- + H2O + SO2
SO32- + 2H+ → H2O + SO2
В) Pb(NO3)2 + Na2SO4 → PbSO4 + 2NaNO3
Pb+2 + 2NO3- + 2Na+ + SO42- → PbSO4 + 2Na+ + 2NO3-
Pb+2 + SO42- → PbSO4
Задача.
Назовите по научной номенклатуре предельный углеводород, имеющий углеводородный скелет
C-C-C-C-C-C-C
| |
C C
|
C
Решение:
В этом соединении нумерацию определяет радикал этил как ближайший к краю цепи (локант) с цифрой 3, но метил по алфавиту предшествует этилу, поэтому в названии ставится
первым:
1 2 3 4 5 6 7
С-С-С-С-С-С-С
| |
С С
|
С
Ответ: 4-метил-З-этилгептан.
Задача.
Составьте структурные и молекулярные формулы следующих веществ:
а) 2метил 2 этилгексан;
б) 2этилбутен-1.
Для решения задачи необходимо:
-
По последней части названия определить, сколько атомов углерода содержится в основной углеродной цепи; -
Определить наличие кратных связей в молекуле углеводорода; -
Расставить радикалы; -
Дописать недостающие атомы углерода.
а) 2метил 2 этилгексан
СН3
|
Н3С-С-СН2-СН2-СН2-СН3
|
С2Н5
б) 2этилбутен-1
Н2С=С-СН2-СН3
|
С2Н5
Задача.
Сколько литров углекислого газа выделится при сжигании 10 литров пропана?
Для решения задачи необходимо:
-
Записать, что дано и что найти; -
Записать уравнение реакции и уравнять его; -
Над уравнением реакции записать данные; -
Под уравнением реакции записать значение молярного объема для газов; -
Составить и решить пропорцию; -
Записать ответ.
-
Дано:
V(С3Н8)=10л.
Найти:
V(СО2)-?
Решение:
V=10л. V=Хл.
С3Н8 + 5О2 = 3СО2 + 4Н2О
Vm=22,4л/моль Vm=67,2л/моль
Х= 10х67,2/22,4=30(л.)
Ответ: при сжигании 10 литров пропана выделится 30 литров углекислого газа.
Задача.
Назовите по международной номенклатуре карбоновую кислоту следующего состава:
СН3 - СН -СН - СН2 – СООН
| |
СН3 С2Н5
Для решения задачи необходимо:
-
Пронумеровать углеродную цепь, обозначая номером 1 карбоксильную группу; -
Определить локанты для замещающих групп - для радикала метила он будет 4, для этила – 3; -
Название - 4-метил-3-этилпентановая кислота, так как по международной номенклатуре предпочтение отдается перечислению заместителей в алфавитном порядке.
ЗАДАНИЯ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
Задачи с 1- 10
Задание:
Пользуясь Периодической системой химических элементов, дайте характеристику химическому элементу с известным порядковым номером по плану:
-
Порядковый номер химического элемента. -
Символ химического элемента. -
Номер периода. -
Номер группы. -
Подгруппа (главная, побочная). -
Атомная масса. -
Количество энергетических уровней. -
Электронная схема и электронная формула атома. -
Количество электронов на последнем энергетическом уровне. -
Количество протонов. -
Количество электронов. -
Количество нейтронов. -
Формула летучего водородного соединения. -
Формула высшего оксида.
Задача 1: №10, №24.
Задача 2: №17, №13.
Задача 3: №16, №10.
Задача 4: №23, №4.
Задача 5: №24, №6.
Задача 6: №25, №8.
Задача 7: №37, №9.
Задача 8:1№9, №34.
Задача 9: №20, №7.
Задача 10: №16, №5.
Задачи 11-20
Задание:
По названию химических соединений составьте химические формулы веществ, напишите уравнения диссоциации и рассчитайте их молекулярный вес:
Задача 11 Оксид меди, оксид аммония, силикат натрия.
Задача 12 Оксид кальция, гидроксид калия, сульфат алюминия.
Задача 13 Бромид аммония, сульфит бария, нитрат свинца.
Задача 14 Карбонат натрия, хлорид аммония, нитрит
алюминия.
Задача 15 Силикат натрия, хлорид алюминия, карбонат калия.
Задача 16 Силикат свинца, бромид аммония, сульфид бария.
Задача 17 Карбонат меди, нитрат свинца, хлорид бария.
Задача 18 Карбонат железа III, хлорид алюминия, сульфат калия.
Задача 19 Сульфит бария, гидроксид меди, оксид свинца.
Задача 20 Силикат свинца, сульфат цинка, нитрит натрия.
Задачи с 21- 30
Задание:
Напишите уравнения полной диссоциации в водных растворах следующих электролитов:
| Задача 21 А)HNO3, H2SO4 Б)NaOH, NH4OH, Ca(OH)2 В)Fe2(SO4)3, Mg(NO3)2 Задача 22 А)H2SeO4, HBr Б)Ba(OH)2, KOH В)K3PO4, KCl, (NH4)2SO4 Задача 23 А)H3AsO4, HClO4 Б)Sr(OH)2, LiOH В)Al2(SO4)3, K2CO3, ВаCO3 Задача 24 А)HNO3, H2SO4 Б)NaOH, NH4OH, Ca(OH)2 В)Fe2(SO4)3, Mg(NO3)2 Задача 25 А)H2SeO4, HBr Б)Ba(OH)2, KOH В)K3PO4, KCl, (NH4)2SO4 | Задача 26 А)H3AsO4, HClO4 Б)Аl(OH)3, LiOH В)Al2(SO4)3, K2CO3, NaHCO3 Задача 27 А)HNO3, H2SO4 Б)NaOH, NH4OH, Ca(OH)2 В)Fe2(SO4)3, Mg(NO3)2 Задача 28 А)H2SO4, HBr Б)Ba(OH)2, KOH В)K3PO4, KCl, (NH4)2SO4 Задача 29 А)H3AsO4, HClO4 Б)Sr(OH)2, LiOH В)Al2(SO4)3, KNO3, Na2CO3 Задача 30 А)HNO3, H2SO3 Б)NaOH, NH4OH, Ca(OH)2 В)Fe2(SO4)3, Mg(NO3)2 |
