Файл: Методические указания и контрольные задания для студентовзаочников для специальностей.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.10.2024
Просмотров: 12
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Задачи с 31- 40
Задание:
Напишите уравнения реакций в молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной формах
Задача 31
А)хлорид железа(III) + гидроксид натрия
Б)сульфит цинка + серная кислота
В)нитрат свинца(II) + сульфат калия
Задача32
А)сульфат цинка + гидроксид натрия
Б)хлорид хрома (III) + фосфат калия
В)карбонат кальция + азотная кислота
Задача 33
А)нитрат никеля (III) + карбонат натрия
Б)сульфид железа (II) + азотная кислота
В)гидроксид калия + хлорид алюминия
Задача 34
А)гидроксид меди (II) +серная кислота
Б)карбонат натрия + хлорид магния
В) нитрат свинца (II) + гидроксид натрия
Задача 35
А)гидроксид магния + соляная кислота
Б)нитрат никеля (II) + гидроксид калия
В)фосфат натрия + сульфат магния
Задача 36
А) силикат натрия + азотная кислота
Б)карбонат магния + хлороводородная кислота
В) нитрат свинца (II) + гидроксид калия
Задача 37
А)сульфат меди (II) + хлорид бария
Б)бромид железа (III) + гидроксид бария
В) хлорид цинка + гидроксид лития
Задача 38
А)хлорид меди (II) + нитрат серебра
Б)нитрат ртути (II) + сульфид натрия
В)бромид марганца (II) + гидроксид натрия
Задача 39
А) сульфит натрия + соляная кислота
Б)хлорид аммония + гидроксид натрия
В) сульфат меди (II) + хлорид бария
Задача 40
А)хлорид железа(III) + гидроксид натрия
Б)сульфит цинка + серная кислота
В)Нитрат свинца(II) + сульфат калия
Задачи 41- 50
Задание:
Раскройте понятие химических терминов и законов, область их применения, приведите примеры:
Задача 41
Валентность, закон постоянства состава.
Задача 42
Относительная молекулярная масса, моль.
Задача 43
Оксид, кислота.
Задача 44
Основания, соль.
Задача 45
Периодический закон Д.И. Менделеева, соль.
Задача 46
Изотопы, ионная связь.
Задача 47
Водородная связь, ковалентная связь.
Задача 48
Гидролиз соли, окислительно- восстановительная реакция
Задача 49
Металлическая связь, относительная молекулярная масса
Задача 50
Валентность, восстановитель.
Задачи 51-60
Задание:
Дайте полную характеристику металлу по плану:
1.положение в Периодической таблице химических элементов
Д.И. Менделеева.
2.физические свойства.
3.нахождение в природе.
4.получение в чистом виде.
5.важнейшие соединения.
6.применение.
Задача51 Задача52 Задача53 Задача54 Задача55
Никель Хром Железо Алюминий Свинец
Задача56 Задача 57 Задача58 Задача59 Задача60
Титан Олово Медь Серебро Платина
Задачи 61-70
Задание:
Какие из следующих углеводородов являются предельными, рассчитайте их молекулярный вес и назовите. Составьте структурные и молекулярные формулы двух гомологов для предельного углеводорода, назовите их:
61. СН4 , С6 Н6
62. С2 Н6 , С2 Н2
63. С3 Н8 , С4 Н8
64. С4 Н10 , С2 Н2
65. С5 Н12 , С3 Н6
66. С6 Н14 , С2 Н4
67. С3 Н8 , С5 Н10
68. С2 Н6 , С20 Н40
69. С5 Н12 , С2 Н4
70. С4 Н10 , С3 Н6
Задачи 71-80
Задание:
Составьте структурные и молекулярные формулы органических соединений:
| 71.триметил этил метан диметил этил метан 2,3 диметил пентан 3 метил, 3 этил пентан 72. 2,3,4 триметил пентан 2 метил пропан 2 метил бутен-2 2,3 диметил гексен -3 73. 2 метил пропен-1 2,5,5 триметил гексен -2 2 метил гексодиен-1,5 2,4 диметил пентадиен-2,4 74. 2 метил пропен-1 триметил этил метан диметил этил метан 2,3 диметил пентан 75. 3 метил, 3 этил пентан 2,3,4 триметил пентан 2 метил пропан 2 метил бутен-2 | 76. 2,3 диметил гексен -3 2 метил пропен-1 2,5,5 триметил гексен -2 2 метил гексодион-1,5 77. 2,4 диметил пентадиен-2,4 2 метил пропен-1 триметил этил метан 78.2,3 диметил пентан 3 метил, 3 этил пентан 2,3,4 триметил пентан 2 этил пропан диметил этил метан 79. 2 метил бутен-2 2,3 диметил гексен -3 2 метил пропен-1 2,5,5 триметил гексен -2 80. диметил этил метан 2,3 диметил пентан 2,5,5 триметил гексен -2 2 метил гексодиен-1,5 |
Задачи 81-90
Задание:
Рассчитайте, сколько литров углекислого газа выделится при сжигании:
81.30 литров метана
82. 40 литров этана
83. 50 литров пропана
84. 40 грамм пентана
85. 60 литров бутана
86. 20 литров этилена
87. 25 литров пропена
88. 30 граммов пентана
89. 80 граммов гексана
90. 150 граммов этена
Задачи 91-100
Задание:
Рассчитайте, сколько литров кислорода (условия нормальные) расходуется на сжигании метра кубического газовой смеси, состоящей из:
91. 75% метана, 15% этана, 5% водорода;
92. 65% метана, 25% этана, 10% водорода;
93. 10% метана, 25% этана, 65% водорода;
94. 30% метана, 20% этана, 50% водорода;
95. 20% метана, 30% этана, 50% водорода;
96. 25% метана, 20% этана, 55% водорода;
97. 30% метана, 30% этана, 40% водорода;
98. 40% метана, 30% этана, 30% водорода;
99. 70% метана, 20% этана, 10% водорода;
100. 10% метана, 70% этана, 70% водорода;
Задачи 101-110
Решите задачи
101. Какие углеводороды и в каком количестве получаются при дегидратации 10 кг: а) этилового спирта; б) пропилового спирта?
102. Какой объем водорода необходим для гидрирования 12,4г смеси газов, содержащих 22,58% этена, 32,26% пропена и 45,16% бутена-2? Напишите соответствующие уравнения реакций.
103. Сколько граммов галогенопроизводного образуется в результате взаимодействия 1,12 л пропилена с хлороводородом?
104. Какой объем водорода необходимо затратить для гидрирования смеси объемом 10л, состоящей из этена (массовая доля 20%) и этана (80%)? Какой объем этана при этом получится?
105. Сколько литров кислорода (у.н.) потребуется для полного сгорания ацетилена массой 6,5г?
106. Сколько граммов толуола получится при взаимодействии бензола массой 15,6 г с хлорметаном?
107. Как из метана можно получить бензол? Сколько литров метана необходимо затратить на получение бензола массой 7,8г?
108. Сколько граммов этилового спирта необходимо взять для получения уксусноэтилового эфира массой 35,6г, если выход продукта составляет 80% от теоретического?
109. Сколько граммов уксусной кислоты необходимо для реакции этерификации, если известно, что в результате ее получается этилацетат массой 118,8г, выход которого составляет 90% от теоретического?
110. При гидролизе жира (твердого) были получены стеариновая кислота и глицерин массой 184г. Вычислите массу прореагировавшего жира.
Задачи 111-120
Выполните задания
111. Напишите структурные формулы:
а) 2-метилбутена-2; б) 2-метилпроиена-1;
в) 2,3-диметилгексена-З; г) 2,5,5-триметилгексена-2;
д) 2,2,6-триметал-4-этилгситена-3.
112. Напишите структурные формулы:
а) 2-метил бутадиена-1,3; б) 2-метнлгексадиена-1,5;
в)2,4-диметилпентадиена-2,4; г)2-метилпентадисна-1,3. 113. Напишите структурные формулы:
а) 2-метил-З-этилбензола;
б) 1,3,5-триметилбензола;
в) 1-метил-4-изобутилбензола;
г) 1,4-диизопропилбензола.
114. Напишите структурные формулы: а) фенилпропана;
б) фенилгексана; в) фенилэтана; г) фенилбутана.
115. Назовите по международной номенклатуре
следующие карбоновые кислоты:
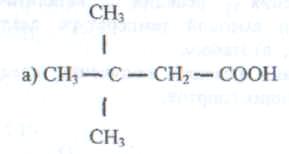
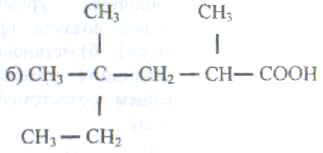
116 Какому названию кислоты соответствует данная формула?
а) 3-хлорбутановая;
б) 1-хлорпропановая;
в) 4-хлорбутановая; соответствует вещество со структурной формулой:
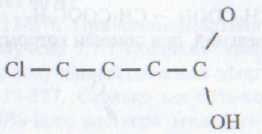
117. Как получают уксусную кислоту в промышленности?
Назовите три основных способа.
118. При взаимодействии муравьиной кислоты с этиловым спиртом был получен сложный эфир. Напишите структурную формулу и назовите полученный сложный эфир.
119. Запишите уравнения реакций, при помощи которых можно осуществить следующий цикл превращений:
СаС2 → С2Н2 → СН3СОН → СН3СООН
120. Назовите по рациональной номенклатуре следующие соединения:
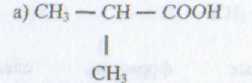
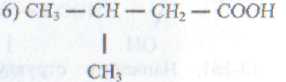
ВОПРОСЫ И ЗАДАНИЯ К ЗАЧЕТУ
1. Чему равна молекулярная масса карбоната кальция?
2. Ч то такое химический элемент?
3. Чем простые вещества отличаются от сложных?
4. Что такое аллотропия?
5. Чем качественный состав веществ отличается от количественного?
6. Вычислите относительную молекулярную массу фосфата магния.
7. Что такое количество вещества?
8. Сформулируйте закон сохранения массы веществ.
9. Какое значение для современной науки имеет открытие Д.И. Менделеевым Периодического закона?
10. Опишите структуру периодической таблицы химических элементов.
11. Опишите строение атома химического элемента.
12. Какие типы химической связи вам известны? Дайте определения.
13. Что такое гомогенные смеси?
14. Приведите классификацию дисперсных систем.
15. Что такое коллоидные системы?
16. Вычислите массовую долю хлорида калия в растворе, приготовленном из 20 граммов соли и 80 граммов воды.
17. Что такое электролитическая диссоциация?
18. Чем обусловлена жесткость воды? Какие способы ее устранения вам известны?
19. Опишите химические свойства кислот в свете теории электролитической диссоциации.
20. Приведите классификацию оснований по различным признакам.
21. Что такое кислые соли? Приведите примеры.
22. Какие группы оксидов вам известны? Приведите примеры.
23. На какие группы классифицируются химические реакции по тепловому эффекту? (Классификация химических реакций по тепловому эффекту)
24. Что такое степень окисления?
25. Какие реакции называются окислительно-восстановительными?
26. От каких факторов зависит скорость химических реакций?
27. Охарактеризуйте общие способы получения металлов.
28. Что такое сплавы? Приведите примеры черных и цветных сплавов.
29. Опишите особенности строения атомов неметаллов.
30. Что такое коррозия металлов? Приведите примеры способов защиты металлов от коррозии.
31. Охарактеризуйте основные положения теории химического строения органических соединений А.М. Бутлерова.
32. Приведите классификацию органических веществ по строению углеродного скелета и наличию функциональных групп.
33. Запишите формулы 2 гомологов и 2 изомеров для пентана.
34. Что такое алканы? Опишите области применения метана.
35. Какие химические реакции характерны для предельных углеводородов?
36. Какие углеводороды относятся к гомологическому ряду алкенов?
37. Опишите области применения этилена.
38. Что такое алкадиены?
39. Составьте структурную формулу 2-метилбутадиена-1,3.
40. Опишите области применения алкадиенов.
