Файл: Физикохимические основы жидкостной хромотографии. Фазовые превращения в двухкомпонентной системе.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 32
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Приборостроительный факультет
Кафедра «Микро- и нанотехника»
КУРСОВАЯ РАБОТА
по дисциплине «Физическая химия»
на тему
«Физико-химические основы жидкостной хромотографии. Фазовые превращения в двухкомпонентной системе»
Исполнитель: студент группы 11310121
Сороко П. А.
Руководитель: доцент, к.т.н.
Колонтаева Т.В.
2023
Содержание
ВВЕДЕНИЕ 3
1. Физико-химические основы жидкостной хроматографии 4
1.1 Коллоидная химия. Основные понятия 4
1.1.1 Коллоидная химия как наука 4
1.1.2 Основные понятия 4
1.2 Колоидные системы. Классификация. 5
1.2.1 Колоидные системы 5
1.1.2 Классификация колоидных систем 6
Список используемой литературы 8
ВВЕДЕНИЕ
Коллоидная химия – раздел физической химии, в котором рассматриваются процессы образования и разрушения дисперсных систем, а также характерные свойства, связанные в основном с поверхностными явлениями на границах раздела фаз в этих системах. Термин «коллоидная химия» связан с тем, что по традиции коллоидами называют наиболее высокодисперсные системы с предельно развитой поверхностью раздела фаз (коллоидные системы). В современном ее значение коллоидная химия является физико-химией дисперсных систем и поверхностных явлений.
Основные направления современной коллоидной химии:
1. Термодинамика поверхностных явлений.
2. Изучение адсорбции ПАВ.
3. Изучение образования и устойчивости дисперсных систем, их молекулярно-кинетических, оптических и электрических свойств.
4. Физика-химическая механика дисперсных структур.
5. Разработка теории и молекулярных механизмов процессов, происходящих в дисперсных системах под влиянием ПАВ, электрических зарядов, механического воздействия и т.п.
Также в коллоидной химии большую главу занимают золи. [10]
Золи – высокодисперсная коллоидная система (коллоидный раствор) с жидкой (лиозоль) или газообразной (аэрозоль) дисперсных средой, в объёме в которой распределена другая (дисперсная) фаза в виде капелек жидкости, пузырьков газа или мелких твердых частиц, размер которых лежит в пределе от
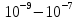
м.
Имеется два типа золей:
1. Лиофобные золи
2. Лиофильные золи
Эти два типа золей подвергаются двум процессом: устойчивость и коагуляция.
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени. Скорость коагуляции золя электролитами зависит как от концентрации самого золя, так и от концентрации электролитов. Основным способом коагуляция для этих двух типов золей является коагуляция с помощью электролитов.
Устойчивость золей – способность коллоидных частиц удерживаться во взвешенном состоянии, не подвергаясь седиментации. [6]
1. Физико-химические основы жидкостной хроматографии
1.1 Коллоидная химия. Основные понятия
1.1.1 Коллоидная химия как наука
Под коллоидной химией понимают науку о поверхностных явлениях и дисперсных системах. [3]
К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряженных фаз. Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие разного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны одной и другой фазы существует ненасыщенное поле межатомных, межмолекулярных сил.
Дисперсные система – наиболее типичные и вместе с тем сложные объекты коллоидной химии, потому что в них проявляется все многообразие поверхностных явлений, формирующих особые объёмные свойства эти систем. Дисперсными системами является большинство окружающих нас реальных тел, поэтому есть основания называть науку о поверхностных явлениях и дисперсных системах физикой и химией реальных тел.
Таким образом, коллоидная химия изучает наиболее распространенное в природе состояние тел – дисперсное состояние и его превращения. Универсальность дисперсного состояния, наличие внешней и внутренней поверхности у большинства реальных тел определяет фундаментальный и общенаучный характер коллоидной химии.
Значение коллоидной химии исключительно велико, так как в ней изучаются не только общие вопросы познания физической сущности окружающего нас материального мира, но и вопросы, тесно и непосредственно связанные с проблемами самой жизни, поскольку все живое состоит из сложнейших комплексов веществ в коллоидном состоянии. [4]
Коллоидная химия ставит своей задачей изучение физико-химических свойств:
А. Всех высокодисперсных гетерогенных систем, кладя в основу поверхностные явления на границе фаз;
Б. Высокомолекулярных и высокополимерных соединений — как в твердом состоянии, так и в состоянии раствора. [9]
1.1.2 Основные понятия
Для коллоидной химии характерны два общих признака: гетерогенность и дисперсность. Все особые свойства, характерные для объектов коллоидной химии, является функциями или следствием гетерогенности и дисперсности.
Гетерогенность или многофазность, выступает в коллоидной химии как признак, указывающий на наличие межфазной поверхности, т.е. поверхностного слоя – основного объекта этой науки. Гетерогенность качественно обусловливает характерные особенности дисперсных систем, являясь, таким образом, первичным признаком объектов коллоидной химии.
Дисперсность (раздробленность) – второй признак объектов коллоидной химии – определяется размерами и геометрией частиц дисперсной фазы. Именно дисперсность является важнейшим признаком объектов коллоидной химии, ведь она придает новые свойства не только отдельным элементам дисперсий системы, но и всей дисперсной системе.
Сопоставляя два основных признака коллоидной химии, необходимо отметить, что дисперсность является чисто количественным параметром, характеризующим степень раздробленности, размер межфазной поверхности; гетерогенность же в первую очередь указывает на качественную характеристику объектов, что более важно при установлении отличительных особенностей объектов той или иной науки. [4]
Структурной и кинетической единицей коллоидных систем является не ион и не молекула в обычном смысле, а либо комплекс (агрегат), состоящий из большого числа обычных молекул, атомов или ионов, называемы мицеллой, либо макромолекула, т. е. молекула-полимер «гигантских» размеров, обладающая молекулярным весом в десятки и сотни тысяч углеродных единиц. [9]
1.2 Колоидные системы. Классификация.
1.2.1 Колоидные системы
Коллоидной системой (золем) называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы. Это ультрамикрогетерогенные системы, состоящие из частиц дисперсной фазы –
совокупности раздробленных частиц, размер которых лежит в пределах 10-9 м – 10-5 м, и непрерывной дисперсионной среды, в которой распределены эти частицы.
Раздробленность дисперсной фазы характеризуется степенью дисперсности δ, которая является величиной, обратной среднему диаметру (м-1):
| | | 1 | (4.1) |
| | d | ||
| | | |
Удельная поверхность – это отношение общей площади поверхности дисперсной фазы Sд.ф. к еѐ общему объему или к ее массе:
| S уд.,V | | Sдисп..фазы | , м-1 или | S уд.,m | Sдисп.фазы. | , м2/г |
| | | |||||
| | | Vдисп..ф. | | mдисп.фазы. | ||
Коллоидное состояние вещества имеет два основных признака ––дисперсность и гетерогенность.
Для получения коллоидных растворов необходимо:
1)достичь коллоидной степени дисперсности;
2)подобрать дисперсионную среду, в которой нерастворимо вещество дисперсный фазы;
3)подобрать третий компонент – стабилизатор, сообщающий коллоидной системе устойчивость. В качестве стабилизаторов используют вещества, препятствующие агрегации (слипанию) коллоидных частиц в более крупные и выпадению их в осадок (небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы; ПАВ; белки; полисахариды).
1.1.2 Классификация колоидных систем
В основе классификаций лежат различные свойства дисперсных систем: размер частиц дисперсной фазы, агрегатное состояние дисперсной фазы и дисперсионной среды
, характер взаимодействия дисперсной фазы с дисперсионной средой, структурно-механические и др. свойства.
Классификация по агрегатному состоянию фаз.
| | Агрегатное состояние дисперсной фазы | Агрегатное состояние дисперсионной среды | Условное обозначение, ф/с | Название системы | Примеры |
| | | | |||
| | | | | | |
| | ж | г | ж/г | аэрозоли | Туман, слоистые облака |
| | тв | г | тв/г | Дымы, пыли, перистые облака | |
| | | ||||
| | | | | газовые эмульсии, | Газированная вода, мыльная пена, |
| | г | ж | г/ж | лечебный кислородный коктейль, | |
| | пены | ||||
| | | | | пивная пена | |
| | | | | | |
| | ж | ж | ж/ж | эмульсии | Молоко, масло сливочное, |
| | маргарин, кремы и т.д. | ||||
| | | | | | |
| | тв | ж | тв/ж | лиозоли, суспензии | Естественные водоѐмы, краски, |
| | красители для ткани | ||||
| | | | | | |
| | | | | | Пемза, твѐрдые пены, пенопласт, |
| | г | тв | г/тв | твѐрдые пены | активированный уголь, пенобетон, |
| | | | | | хлеб, пористые тела в газе |
| | | | | | Вода в парафине, природные |
| | ж | тв | ж/тв | твѐрдые эмульсии | минералы с жидкими включениями, |
| | | | | | древесина |
| | тв | тв | тв/тв | твѐрдые золи | Сталь, чугун, цветные стѐкла, |
| | драгоценные камни | ||||
| | | | | |

