Файл: Определение степени диссоциации слабого электролита.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Таблица 4 – Зависимость величин эквивалентной и удельной электропроводностей раствора от концентрации слабого электролита
| Электролит | СN, экв/л | ∙10-4, См/м | λ∙10-4, См∙м2/экв | 1/λ | λС∙10-8 |
| уксусная кислота | 0,1 | 605,7 | 6,057 | 1650,98 | 6,057 |
| 0,02 | 282,7 | 14,135 | 707,46 | 2,82 | |
| | 0,004 | 129,8 | 32,45 | 308,2 | 1,298 |
| | 0,0008 | 55,12 | 6,89 | 145,14 | 0,55 |
Примечание – Так как уксусная кислота одноосновна, то ее молярная масса равна эквиваленту. Следовательно, нормальная концентрация равна молярной концентрации.
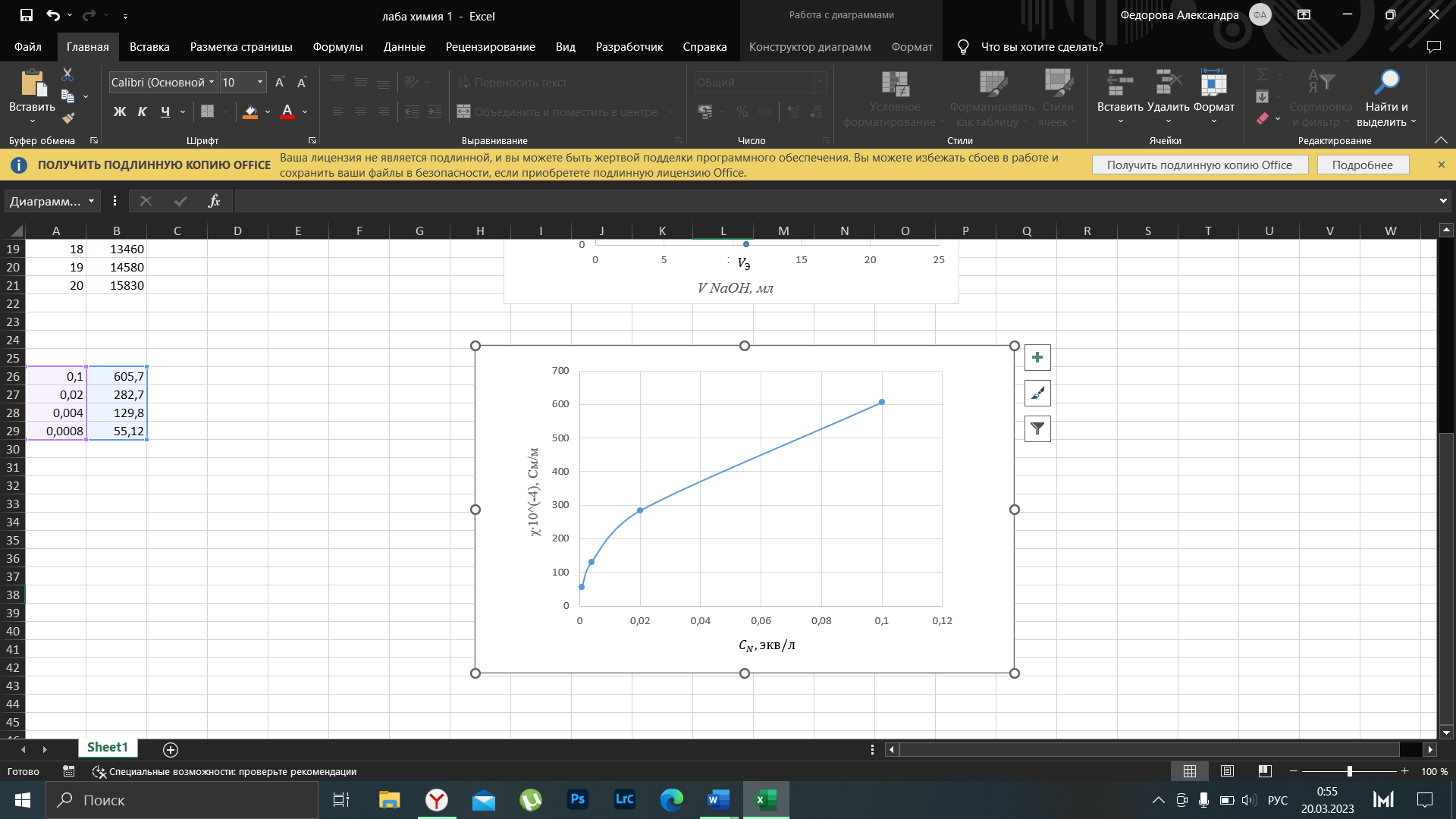
Рисунок 3 – График зависимости = f(C)
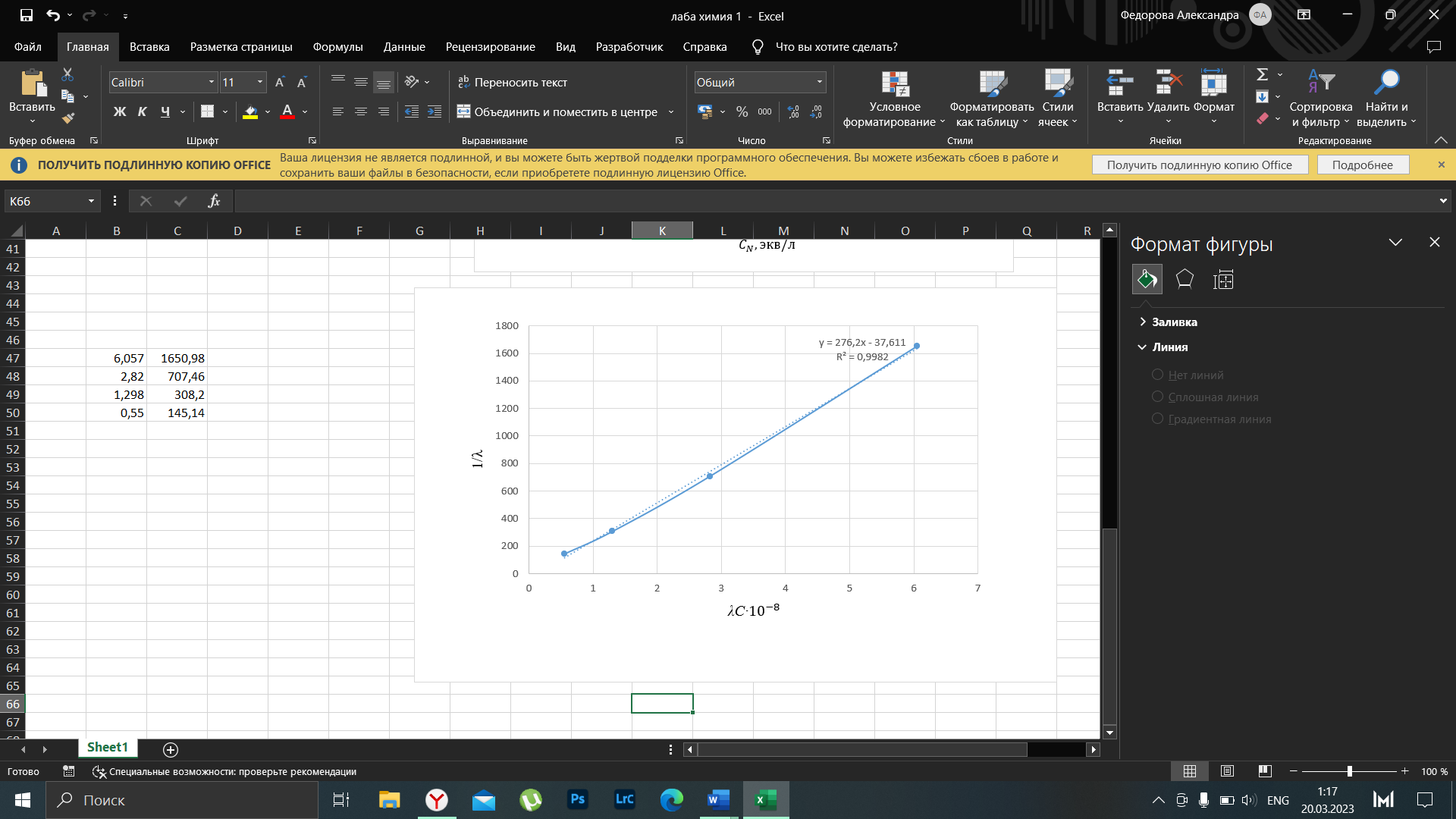
Рисунок 4 – График зависимости 1/λ = f(λС)
По графику линия тренда пересекает ось ординат при 1/λ=-37,611. Используя абсолютное значение
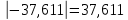 , получим следующее:
, получим следующее: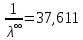
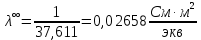
По справочным материалам для уксусной кислоты:
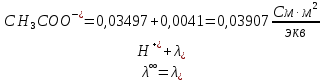
2.2 Расчет значения степени диссоциации по уравнению:
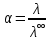 | (3) |
где
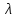 – эквивалентная электропроводность соответсвующего раствора, См∙м2/экв;
– эквивалентная электропроводность соответсвующего раствора, См∙м2/экв;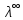 – предельная эквивалентная электропроводность уксусной кислоты при
– предельная эквивалентная электропроводность уксусной кислоты при
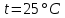 ,
, 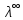 =0,03907См∙м2/экв.
=0,03907См∙м2/экв.Пример расчета степени диссоциацииСN=0,1экв/л. Для последующих значений вычисления проведены аналогично.
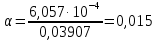
2.3 Расчет значения константы диссоциации по уравнению:
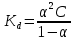 | (4) |
где
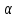 – степень диссоциации соответсвующего раствора;
– степень диссоциации соответсвующего раствора;С – концентация, моль/л.
Пример расчета константы диссоциации для С=0,1моль/л. Для последующих значений вычисления проведены аналогично.
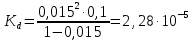
Таблица 5 – Значения степени и константы диссоциации
| Электролит | С, моль/л | 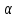 | 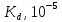 | Δ 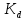 = =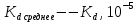 |
| уксусная кислота | 0,1 | 0,015 | 2,28 | 0,37 |
| 0,02 | 0,036 | 2,68 | -0,03 | |
| 0,004 | 0,083 | 3,005 | -0,355 | |
| | 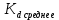 =2,65 =2,65 | | ||
2.4 Расчет среднеквадратичного отклонения по уравнению:
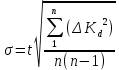 | (5) |
где t– коэффициент Стьюдента. Для доверительной вероятности 0,95t = 3,2;
n – количество измерений.
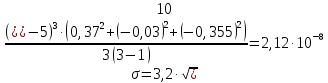
2.5 Окончательный результат
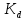 =(2,65±2,12)∙10-5
=(2,65±2,12)∙10-5 ЗАКЛЮЧЕНИЕ
В процессе выполнения лабораторной работы были получены навыки кондуктометрического титрования, использования кондуктометра для измерения удельной электропроводности растворов.
Практически полученное значение константы диссоциации уксусной кислоты несколько меньше теоретического при t=25˚C(Kd=2,65∙10-5). Возможно, неточность является следствием отличной от комнатной температуры в лаборатории и малого опыта экспериментальной работы обучающихся.
Порядок вычисленного значения предельной эквивалентной электропроводности раствора уксусной кислоты совпадает со справочным, но экспериментально полученную величину не следует использовать в дальнейших расчетах из-за низкой точности. Вероятно,такое расхождение получено вследствие недостаточного очищения (промывки) электродов кондуктометра от предыдущего раствора.
При выполнении работы была по достоинству оценена необходимость внимательности и аккуратности в проведении эксперимента.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
-
Глинка Н.Л. Общая химия — 1985. — С. 228-233 -
Расчет равновесий в аналитической химии. Константы диссоциации некоторых кислот[Электронный ресурс] URL: https://chemequ.ru/справочники/константы_диссоциации_кислот/ -
Санкова Л.А. КубГТУ. Применение метода кондуктометрического титрования в пищевой промышленности. Студенческий научный форум – 2017. [Электронный ресурс] URL: https://scienceforum.ru/2017/article/2017032001
Санкт-Петербург
2023


