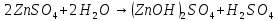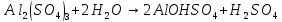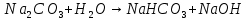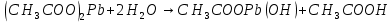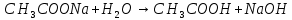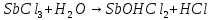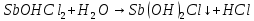Файл: Лабораторная работа 6 По дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы Исследование гидролиза солей студент гр. Эрб221 Иванов Л. А.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 09.02.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| | | |
Министерство образования и науки Российской Федерации

Федеральное государственное бюджетное образовательное учреждение высшего образования
Санкт-Петербургский горный университет
Кафедра общей химии
Лабораторная работа №6
По дисциплине Химия
(наименование учебной дисциплины согласно учебному плану)
Тема работы: Исследование гидролиза солей
Выполнил: студент гр. ЭРБ-22-1 ____________ Иванов Л. А.
(шифр группы) (подпись) (Ф.И.О.)
Оценка:
Дата:
Проверил:
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2022
Цель работы:
Ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
Общие сведения:
Гидролиз соли – это реакция обменного разложения соли водой (реакция, обратная реакции нейтрализации). При гидролизе ионы, образующиеся при диссоциации соли, могут отрывать от молекулы воды катионы водорода или гидроксидионы. При этом равновесие, характерное для чистой воды, перестает выполняться, и среда раствора становится кислой или щелочной. В реакцию гидролиза вступают только соли, образованные хотя бы одним слабым электролитом, а именно: соли слабой кислоты (или амфолита как кислоты) и сильного основания; соли слабого основания (или амфолита как основания) и сильной кислоты; соли слабой кислоты и слабого основания. Соли сильной кислоты и сильного основания в реакцию гидролиза в обычных условиях не вступают – реакция среды нейтральная.
Гидролиз соли, образованной сильным основанием и слабой кислотой: Гидролизуется анион слабой кислоты: А- + Н2О = НА + ОН-, в растворе появляются ионы ОН-, поэтому среда – щелочная, рН > 7.
Гидролиз соли, образованной слабым основанием и сильной кислотой: Гидролизуется катион слабого основания: М
+ + Н2О Û МОН + Н+, в растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
Гидролиз соли, образованной двумя слабыми электролитами:
Гидролиз протекает как по катиону, так и по аниону: М+ + А- + Н2О = МОН + НА. Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Степень гидролиза соли, образованной слабой кислотой и слабым основанием многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами гидролиза являются труднорастворимые соединения или газы, то гидролиз протекает полностью.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
Чем слабее кислота или основание, образующиеся в результате гидролиза, тем выше глубина протекания процесса.
С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Оборудование и реактивы:
В штативе: хлорид железа(III), сульфат цинка(II), сульфат алюминия, сульфат хрома(III), сульфат магния, карбонат натрия, ацетат натрия – растворы концентрацией 5 %; лакмус – раствор концентрацией 1 %. В вытяжном шкафу: соляная кислота – раствор концентрацией 15 %, сульфид натрия – раствор концентрацией 5 %. Получить у преподавателя: спиртовку – 1 шт., песчаную баню – 1 шт., пробирки – 5 шт.; хлорид сурьмы(III), сульфит натрия – растворы концентрацией 5 %; хлорид олова(II) – кристаллический; цинк металлический; универсальную индикаторную бумагу, фенолфталеин.
Порядок выполнения работы:
Опыт 1:
Таблица 6.1
| № | Формула соли | Окраска фенолфталеина | Окраска лакмуса | pH по индикаторной бумаге | Характер вещества |
| 1 | 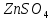 | бесцветный | Сиреневый | 3 | Кислый |
| 2 | 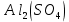 | бесцветный | Персиковый | 2 | Кислый |
| 3 | 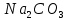 | малиновый | Сиреневый | 12 | Щелочной |
| 4 | 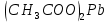 | бесцветный | бледно-розовый | 3 | Кислый |
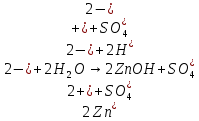
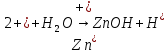
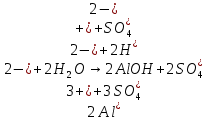
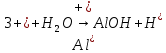
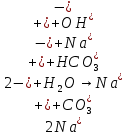
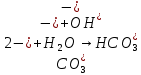
Опыт 2Б
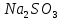 (pH=10) – среда щелочная
(pH=10) – среда щелочная 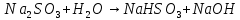
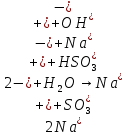
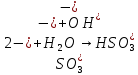
Опыт 3А
Таблица 6.3
| Формула соли | Окраска фенолфталеина | pH | Характер соединения |
| Na2SO3 | Розовый | 10 | Щелочной |
| CH3COONa | Бледно-розовый | 8 | Щелочной |
| Na2CO3 | Ярко-малиновый | 12 | Щелочной |
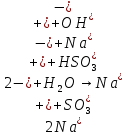
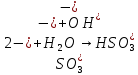
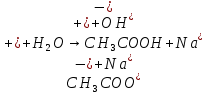
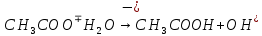
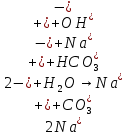
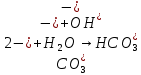
Опыт 3B:
Опыт 4:
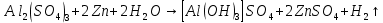
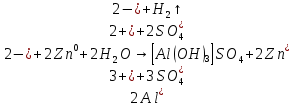
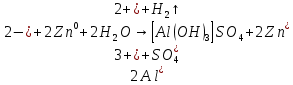
Вывод: Наблюдается неполное растворение цинка и выделение водорода(газ)
Опыт 5:
А)
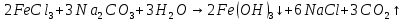
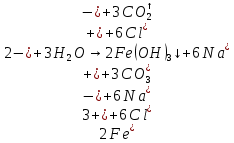
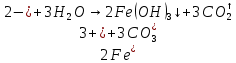
Б)
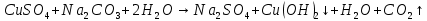
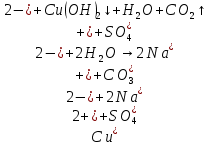
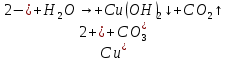
Вывод:
В процессе работы мы на практике ознакомились с процессом гидролиза и его следствиями и научились составлять уравнения гидролиза.
| | | |