Файл: 1. Элементы подгр. 1А. Строение атомов, сравнение свойств атомов, распространение в природе. Получение простых веществ и их свойства.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 34
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ИЗ ЛЕКЦИИ 2Na+O2→Na2O; K+O2→KO2).
Na2O2 + 2Na → 2Na2O
KO2 + 3K → 2K2O
Типичные основные оксиды:
2. Взаимодействуют с кислотами, образуя соль и воду: Na2О + НCl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na2О + SO3 →
4. Взаимодействуют с амфотерными оксидами образуя соли: Na2О + ZnO → Na2ZnO2
Гидроксиды щелочных металлов
NaOH – едкий натр
КОН – едкое кали
LiOH → NaOH → KOH → RbOH → CsOH
1. Электролиз растворов хлоридов:
2NaCl + 2H2O → 2NaOH + H2+ Cl2
2. Обменные реакции между солью и основанием:
K2CO3 + Ca(OH)2→ CaCO3 + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2Li + 2H2O→ 2LiOH + H2
Li2O + H2O→ 2LiOH
Na2O2 + 2H2O→ 2NaOH + H2O2
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl + H2O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO3 → Na2SO4 + H2O
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
2 NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H2O → Na2SiO3 + 2H2↑
6. Взаимодействуют с амфотерными оксидами и гидроксидами
2 NaOH + ZnО + H2O → Na2[Zn(OH)4]
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]
7. При нагревании не разлагаются, кроме LiOH.
4)Оксиды и гидроксиды элементов 2а. Свойства, получение
Соединения металлов главной подгруппы II группы
Оксиды металлов IIА группы
2Са + О2 → 2СаО
2) Термическое разложение нитратов или карбонатов
CaCO3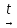 CaO + CO2
CaO + CO2
2Mg(NO3)2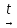 2MgO + 4NO2 + O2
2MgO + 4NO2 + O2
ВеО – амфотерный оксид
Оксиды Mg, Ca, Sr, Ba – основные оксиды
СаО + H2O →
2. Взаимодействуют с кислотами, образуя соль и воду: СаО + НCl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO3 →
4. ВеО взаимодействует со щелочами: ВеО + 2NaOH + H2O → Na2[Ве(OH)4]
Гидроксиды металлов IIА группы
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2 → Вa(ОН)2
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2H2O → Ba(OH)2 + H2
CaO(негашеная известь) + H2O → Ca(OH)2(гашеная известь)
Ве(ОН)2 – амфотерный гидроксид
Mg(ОН)2 – слабое основание
Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные основания – щелочи.
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН)2 + Н2 SO4 →
3. Взаимодействуют с кислотными оксидами.
Са(ОН)2 + SO3 →
4. Взаимодействуют с растворами солей
, если образуется газ или осадок.
Ва(ОН)2 + K2SO4 →
Ве(ОН)2 + 2NaOH → Na2[Ве(OH)4]
5)Алюминий. Характеристика элемента. Получение простого вещества и его свойства.Алюминий — элемент 3-й группы периодической таблицы химических элементов, третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
История: Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году. До открытия промышленного способа получения алюминия этот металл был дороже золота.
Распределение электронов по орбиталям выглядит следующим образом:
+13Al)2)8)3; 1s22s22p63s23p1.
Наиболее характерная степень окисления атома алюминия +3. Отрицательная степень окисления проявляется редко.
Получение: В настоящее время в промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленнном криолите. Al2O3 = Al3+ + AlO33-
Химические свойства:
4Al + 3O2 = 2Al2O3, (реакция сопровождается большим выделением тепла)
2Al + 3S = Al2S3.
Al + P = AlP.
2Al + N2 = 2AlN,
4Al + 3C = Al4C3.
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2;
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O (в качестве продукта восстановления азотной кислоты также может быть азот и нитрат аммония).
Al + 6HNO3 = Al(NO3)3 + 3NO2 + 3H2O.
Алюминий – амфотерный металл, он легко реагирует со щелочами:
в растворе с образованием тетрагидроксодиакваалюмината натрия:
2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2
при сплавлении с образованием алюминатов:
2Al + 6KOH = 2KAlO2 + 2K2O + 3H2.
Алюминий – активный металл, способен вытеснять металлы из их оксидов. Это свойство алюминия нашло практическое применение в металлургии:
2Al + Cr2O3 = 2Cr + Al2O3.
6)Оксид и гидроксид алюминия. Получение и свойства
Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым:
Cr2O3 + Al = Al2O3 + 2Cr
Химические свойства:
Оксид алюминия проявляет амфотерные свойства
1. взаимодействие с кислотами
А12О3 +6HCl = 2AlCl3 + 3H2O
2. взаимодействие со щелочами
А12О3 + 2NaOH – 2NaAlO2 + H2O
Al2O3 + 2NaOH + 5H2O = 2Na[Al(OH)4(H2O)]
3. при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Мп, V, W и др.) в свободном состоянии
2А1 + WO3 = А12Оз + W
4. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза
Al2O3 + Na2CO3 = 2 NaAlO2 + CO2
Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белы, аморфный (гелеобразный) или кристаллический. Почти не растворим в воде;
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
Химические свойства:
1. взаимодействие с кислотами
Al(OH)3 +3HCl = 2AlCl3 + 3H2O
2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + А1(ОН)з = Na[A1(OH)4]
3. термическое разложение
2Al(OH)3 = Al2О3 + 3H2O
Гидроксид алюминия не реагирует с гидратом аммиака, хлоридомаммония, диоксидами углерода и серы, сероводородом.
7.Амфотерность оксида и гидроксида алюминия. Комплексные соединения алюминия.
Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется.
Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами.
Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O
При сплавлении образуется метаалюминат натрия:
Al2O3 (тв)+ 2 NaOH (тв) t→ 2 NaAlO2 + H2O,
В растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4]
Алюминаты неустойчивы и даже при слабом подкислении разрушаются:
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Al(OH)3 – белое вещество, нерастворимое в воде, амфотерный гидроксид.
Получают косвенно реакцией обмена между солью алюминия и щелочью:
AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl
Взаимодействует с кислотами и щелочами.
Al(OH)3 + 3 HCl = AlCl3 + 3 H2O
В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4]
или Al(OH)3 + 3 NaOH = Na3[Al(OH)6]
Врасплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O
Очень часто амфотерные гидроксиды элементов в степени окисления +III существуют также в мета-форме, например:
AlO(OH) - метагидроксид алюминия
FeO(OH) - метагидроксид железа (орто-форма "Fe(OH)3" не существует).
Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения - осаждение из водного раствора с помощью слабого основания - гидрата аммиака:
Al(NO3)3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4NO3 (20 °C)
-
Все оксиды (кроме Li2O) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na2O2 + 2Na → 2Na2O
KO2 + 3K → 2K2O
-
Химические свойства
Типичные основные оксиды:
-
Взаимодействуют с водой, образуя щелочи: Na2О + H2O →
2. Взаимодействуют с кислотами, образуя соль и воду: Na2О + НCl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na2О + SO3 →
4. Взаимодействуют с амфотерными оксидами образуя соли: Na2О + ZnO → Na2ZnO2
Гидроксиды щелочных металлов
-
Общая формула – МеОН -
Физические свойства: Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
-
Сильные основания - Щелочи. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
-
Способы получения:
1. Электролиз растворов хлоридов:
2NaCl + 2H2O → 2NaOH + H2+ Cl2
2. Обменные реакции между солью и основанием:
K2CO3 + Ca(OH)2→ CaCO3 + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2Li + 2H2O→ 2LiOH + H2
Li2O + H2O→ 2LiOH
Na2O2 + 2H2O→ 2NaOH + H2O2
-
Химические свойства
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl + H2O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO3 → Na2SO4 + H2O
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
2 NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H2O → Na2SiO3 + 2H2↑
6. Взаимодействуют с амфотерными оксидами и гидроксидами
2 NaOH + ZnО + H2O → Na2[Zn(OH)4]
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]
7. При нагревании не разлагаются, кроме LiOH.
4)Оксиды и гидроксиды элементов 2а. Свойства, получение
Соединения металлов главной подгруппы II группы
Оксиды металлов IIА группы
-
Общая формула МеО -
Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. -
Способы получения:
-
Окисление металлов (кроме Ba, который образует пероксид)
2Са + О2 → 2СаО
2) Термическое разложение нитратов или карбонатов
CaCO3
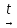 CaO + CO2
CaO + CO22Mg(NO3)2
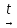 2MgO + 4NO2 + O2
2MgO + 4NO2 + O2-
Химические свойства
ВеО – амфотерный оксид
Оксиды Mg, Ca, Sr, Ba – основные оксиды
-
Взаимодействуют с водой(кроме ВеО), образуя щелочи(MgO – слабое основание):
СаО + H2O →
2. Взаимодействуют с кислотами, образуя соль и воду: СаО + НCl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO3 →
4. ВеО взаимодействует со щелочами: ВеО + 2NaOH + H2O → Na2[Ве(OH)4]
Гидроксиды металлов IIА группы
-
Общая формула – Ме(ОН)2 -
Физические свойства: Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН)2 – в воде нерастворим. -
Основные свойства усиливаются в ряду:
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2 → Вa(ОН)2
-
Способы получения:
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2H2O → Ba(OH)2 + H2
CaO(негашеная известь) + H2O → Ca(OH)2(гашеная известь)
-
Химические свойства
Ве(ОН)2 – амфотерный гидроксид
Mg(ОН)2 – слабое основание
Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные основания – щелочи.
-
Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН)2 + Н2 SO4 →
3. Взаимодействуют с кислотными оксидами.
Са(ОН)2 + SO3 →
4. Взаимодействуют с растворами солей
, если образуется газ или осадок.
Ва(ОН)2 + K2SO4 →
-
Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН)2 + 2NaOH → Na2[Ве(OH)4]
-
При нагревании разлагаются: Са(ОН)2 →
5)Алюминий. Характеристика элемента. Получение простого вещества и его свойства.Алюминий — элемент 3-й группы периодической таблицы химических элементов, третьего периода, с атомным номером 13. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Простое вещество алюминий — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
История: Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году. До открытия промышленного способа получения алюминия этот металл был дороже золота.
Распределение электронов по орбиталям выглядит следующим образом:
+13Al)2)8)3; 1s22s22p63s23p1.
Наиболее характерная степень окисления атома алюминия +3. Отрицательная степень окисления проявляется редко.
Получение: В настоящее время в промышленности алюминий получают электролизом раствора глинозема Al2O3 в расплавленнном криолите. Al2O3 = Al3+ + AlO33-
Химические свойства:
-
С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре:
4Al + 3O2 = 2Al2O3, (реакция сопровождается большим выделением тепла)
-
Выше 200°С реагирует с серой с образованием сульфида алюминия:
2Al + 3S = Al2S3.
-
При 500°С – с фосфором, образуя фосфид алюминия:
Al + P = AlP.
-
При 800°С реагирует с азотом, а при 2000°С – с углеродом, образуя нитрид и карбид:
2Al + N2 = 2AlN,
4Al + 3C = Al4C3.
-
С хлором и бромом взаимодействует при обычных условиях, а с йодом при нагревании, в присутствии воды в качестве катализатора:
2Al + 3Cl2 = 2AlCl3
-
С водородом непосредственно не взаимодействует. -
С металлами образует сплавы, которые содержат интерметаллические соединения – алюминиды, например, CuAl2, CrAl7, FeAl3 и др. -
Очищенный от оксидной пленки алюминий энергично взаимодействует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
-
Легко взаимодействует с разбавленными кислотами, образуя соли:
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2;
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15H2O (в качестве продукта восстановления азотной кислоты также может быть азот и нитрат аммония).
-
С концентрированной азотной и серной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли и продукта восстановления кислоты: 2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O;
Al + 6HNO3 = Al(NO3)3 + 3NO2 + 3H2O.
-
Взаимодействие со щелочами
Алюминий – амфотерный металл, он легко реагирует со щелочами:
в растворе с образованием тетрагидроксодиакваалюмината натрия:
2Al + 2NaOH + 10H2O = 2Na[Al(H2O)2(OH)4] + 3H2
при сплавлении с образованием алюминатов:
2Al + 6KOH = 2KAlO2 + 2K2O + 3H2.
-
Восстановление металлов из оксидов и солей
Алюминий – активный металл, способен вытеснять металлы из их оксидов. Это свойство алюминия нашло практическое применение в металлургии:
2Al + Cr2O3 = 2Cr + Al2O3.
6)Оксид и гидроксид алюминия. Получение и свойства
Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым:
Cr2O3 + Al = Al2O3 + 2Cr
Химические свойства:
Оксид алюминия проявляет амфотерные свойства
1. взаимодействие с кислотами
А12О3 +6HCl = 2AlCl3 + 3H2O
2. взаимодействие со щелочами
А12О3 + 2NaOH – 2NaAlO2 + H2O
Al2O3 + 2NaOH + 5H2O = 2Na[Al(OH)4(H2O)]
3. при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Мп, V, W и др.) в свободном состоянии
2А1 + WO3 = А12Оз + W
4. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза
Al2O3 + Na2CO3 = 2 NaAlO2 + CO2
Гидроксид алюминия – А1(ОН)3. Физические свойства: гидроксид алюминия – белы, аморфный (гелеобразный) или кристаллический. Почти не растворим в воде;
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
Химические свойства:
1. взаимодействие с кислотами
Al(OH)3 +3HCl = 2AlCl3 + 3H2O
2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + А1(ОН)з = Na[A1(OH)4]
3. термическое разложение
2Al(OH)3 = Al2О3 + 3H2O
Гидроксид алюминия не реагирует с гидратом аммиака, хлоридомаммония, диоксидами углерода и серы, сероводородом.
7.Амфотерность оксида и гидроксида алюминия. Комплексные соединения алюминия.
Al2O3 – твердое вещество белого цвета, тугоплавкое. Не реагирует с водой и не растворяется.
Типичный амфотерный оксид, поэтому реагирует с кислотами и щелочами.
Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O
При сплавлении образуется метаалюминат натрия:
Al2O3 (тв)+ 2 NaOH (тв) t→ 2 NaAlO2 + H2O,
В растворе щёлочи образуется тетрагидроксоалюминат натрия:
Al2O3 + 2 NaOH + 3 H2O = 2Na[Al(OH)4]
Алюминаты неустойчивы и даже при слабом подкислении разрушаются:
Na[Al(OH)4] + CO2 = Al(OH)3 + NaHCO3
Al(OH)3 – белое вещество, нерастворимое в воде, амфотерный гидроксид.
Получают косвенно реакцией обмена между солью алюминия и щелочью:
AlCl3 + NaOH (по каплям)= Al(OH)3 ↓ + 3 NaCl
Взаимодействует с кислотами и щелочами.
Al(OH)3 + 3 HCl = AlCl3 + 3 H2O
В растворе: Al(OH)3 + NaOH(избыток) = Na[Al(OH)4]
или Al(OH)3 + 3 NaOH = Na3[Al(OH)6]
Врасплавах: Al(OH)3 + NaOH = NaAlO2 + 2H2O
Очень часто амфотерные гидроксиды элементов в степени окисления +III существуют также в мета-форме, например:
AlO(OH) - метагидроксид алюминия
FeO(OH) - метагидроксид железа (орто-форма "Fe(OH)3" не существует).
Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения - осаждение из водного раствора с помощью слабого основания - гидрата аммиака:
Al(NO3)3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4NO3 (20 °C)

