ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.04.2024
Просмотров: 41
Скачиваний: 0
СОДЕРЖАНИЕ
2. Какая зависимость выражается уравнением Нернста?
3. Какие функции выполняют индикаторные электроды и какие электроды сравнения?
5. В чем сущность и области применения методов прямой потенциометрии?
6. В каких координатах строят кривые потенциометрического титрования?
7. По какому закону изменяется сила тока в ходе прямого кулонометрического определения?
8. Каковы преимущества кулонометрического анализа при контролируемой силе тока?
9. Измерение какого свойства лежит в основе кондуктометрического анализа?
10. Как практически определяют концентрацию методом прямой кондуктометрии?
11. На чем основан поляриметрический метод анализа?
12. Чем характеризуется кулонометрия?
13. Области применения кондуктометрии.
14. Основные типы ионоселективных электродов.
15. В чем различие методов прямой кулонометрии и кулонометрического титрования?
16. Что лежит в основе полярографического метода анализа?
17. Разновидности полярографии?
18. Какой ток называется предельным (диффузионным)?
19. Сущность амперометрического титрования
Контрольные вопросы
-
На чем основаны потенциометрические методы анализа?
Потенциометрический метод анализа основан на измерении потенциалов электродов, погруженных в титруемый раствор.
2. Какая зависимость выражается уравнением Нернста?
Нернст открыл закон, устанавливающий зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией.
Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура.
Уравнению Нернста подчиняются только обратимые окислительно- восстановительные системы в состоянии равновесия.
Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов.
Для реакции, записанной в сторону окисления, выражение записывается в виде:
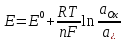
где E0 - стандартный электродный потенциал,
R - газовая постоянная,
T - абсолютная температура,
n - число электронов, участвующих в электродном процессе,
F - постоянная Фарадея (96500 Кл/моль),
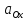 и
и
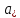 - произведения концентраций (активностей)
веществ, принимающих участие в
соответствующей полуреакции в окисленной
(Ox) и восстановленной (Red) формах.
- произведения концентраций (активностей)
веществ, принимающих участие в
соответствующей полуреакции в окисленной
(Ox) и восстановленной (Red) формах.
3. Какие функции выполняют индикаторные электроды и какие электроды сравнения?
Индикаторный электрод чувствителен к изменению концентрации определяемого иона, поэтому по его потенциалу можно измерить концентрацию анализируемого компонента. Так как измерить абсолютное значение потенциала нельзя, то потенциал индикаторного электрода определяется по значению ЭДС, между индикаторным электродом и электродом сравнения. Электрод сравнения выполняет функцию эталона. Его потенциал известен и остается постоянным на протяжении всего анализа.
Равновесный потенциал индикаторного электрода зависит от активности (концентрации) определяемого компонента в соответствии с функцией, выражаемой уравнением Нернста. На потенциал электрода сравнения активность анализируемого компонента влияние не оказывает
Индикаторный электрод должен быть обратимым, неполяризуемым, химически устойчивым по отношению к контактирующему с ним раствору. Конструкция электрода должна быть простой, а время установления равновесного потенциала минимальным.
Электрод сравнения должен быть химически устойчивым, неполяризуемым , и должен иметь простую конструкцию . Потенциал электрода должен быть стабильным, легко воспроизводимым и не зависеть от состава анализируемого раствора.
4. Как устроен стеклянный электрод? Как с его помощью определяют рН раствора? Какие достоинства и недостатки он имеет?

Стеклянный электрод. Наиболее часто изготавливается в виде стеклянной трубки, на конце которой тонкостенный шарик из стекла специального состава (рис. 6.4).
Внутрь шарика наливают какой-либо буферный раствор и помещают электрод с устойчивым потенциалом (пример: каломельный или хлор серебряный). Вследствие способности стекла обменивать ионы натрия на ионы водорода из раствора, на внутренней и наружной поверхности стеклянного шарика устанавливается ионное равновесие, которое определяет потенциал. Величина потенциала имеет линейную зависимость от pH раствора и не зависит от присутствия окислителей и восстановителей;
Достоинства стеклянных электродов: простота конструкции, высокая чувствительность, хорошая воспроизводимость и стабильность результатов, устойчивость к высоким температурам, действию окислителей, восстановителей.
Недостатками стеклянных электродов являются хрупкость и высокое сопротивление.
5. В чем сущность и области применения методов прямой потенциометрии?
Прямая потенциометрия основана на непосредственном измерении потенциала индикаторного электрода и вычислении активности потенциалопределяющих ионов по уравнению Нернста. Прямой потенциометрический метод часто называют ионометрическим методом анализа (ионометрией).
Метод применяется для определения концентрации водородных ионов или рН растворов. Ионометрия – удобный, простой и экспрессный современный метод: продолжительность анализа определяется временем подготовки пробы (на измерение тратится не более 2 минут).
В методе ионометрии предварительно, пользуясь растворами с известной концентрацией, градуируют электрод (опытным путем определяют зависимость его потенциала от концентрации потенциал-определяющего иона). Затем измеряют потенциал раствора с неизвестной концентрацией определяемого иона и по градуировочному графику находят его содержание.
Ионоселективные электроды позволяют
измерять концентрации ионов до
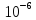 М
в растворе. При этом необходимый для
определения объем раствора составляет
не более 0.1 мл.
М
в растворе. При этом необходимый для
определения объем раствора составляет
не более 0.1 мл.
6. В каких координатах строят кривые потенциометрического титрования?
Крива́я титрова́ния — графическое изображение зависимости определяемой в ходе титрования величины от объёма добавленного стандартного раствора титранта. Построение кривых проводится в инструментальных методаханалитической химии, где отсутствует возможность визуального определения точки эквивалентности (например, по индикатору).
Кривые
потенциометрического титрования
строятся в координатах Е от Vтитр
(интегральная кривая), ∆Е от ∆V
(дифференциальная кривая по первой
производной) ,
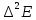 от
от
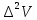 (дифференциальная кривая по второй
производной) и ∆V/∆Е от V(метод Грана).
(дифференциальная кривая по второй
производной) и ∆V/∆Е от V(метод Грана).
Ординатой (осью Y) в графике зависимости является параметр, который фиксируется (pH, напряжение, температура раствора и так далее), а абсциссой(независимой переменной, осью X) — количество добавленного титранта. Иногда абсциссой выступает степень оттитрованности (обозначается τ или f) — соотношение количества вещества титранта к количеству определяемого вещества. Это показатель может использоваться или в виде абсолютного значения, или же в процентах.
Если в ходе титрования фиксированные значения меняются на несколько порядков, для удобства применяют построение логарифмических зависимостей — величину A на оси Y представляют в виде -lg A (аналогично pH, который является логарифмом -lg H+). Логарифмические кривые характерны для кислотно-основных и окислительно-восстановительных титрований.
7. По какому закону изменяется сила тока в ходе прямого кулонометрического определения?
В прямой кулонометрии определяемое вещество реагирует непосредственно на поверхности электрода, поэтому этот метод пригоден для определения только электроактивных веществ. Расчеты, проводимые при применении прямой кулонометрии, не отличаются сложностью. В их основе лежат законы Фарадея, которые формулируются следующим образом:
-
Масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества Q, прошедшего через электролит.
-
Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Суть законов Фарадея заключается в том, что для превращения 1 грамм-эквивалента любого вещества необходимо пропустить через раствор одно и то же количество электричества. Эта величина, равная 96487 Кл/моль, была названа впоследствии постоянной Фарадея — F.
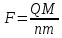
Величину прошедшего количества электричества Q находят методом интегрирования или (для кулонометрии при постоянном токе) путем умножения силы тока на время.
8. Каковы преимущества кулонометрического анализа при контролируемой силе тока?
Кулонометрия при постоянной силе тока — более широко распространенный метод. Для этого метода нет необходимости использовать кулонометр, так как число кулонов можно определить просто умножением величины постоянного тока (которая получается из значения напряжения на стандартном сопротивлении, измеряемого потенциометром ) на время, в течение которого использовался этот ток. Данный метод приложим к ионам, которые или реагируют непосредственно на электроде, НЛП же вступают во взаимодействие с какими-либо получаемыми при электролизе промежуточными веществами при условии, что весь ток используется для протекания некоторой стехиометрической суммарной реакции окисления — восстановления.
Таким образом, в кулонометрическом методе анализа электроны (электрический ток) заменяют стандартный раствор традиционного объемного метода. Благодаря этому исключается длительная операция приготовления стандартных растворов, и можно пользоваться реакциями с участием относительно неустойчивых титрантов. Кроме того, этот метод особенно удобен для миллиграммовых и микрограммовых количеств, весьма точен, удобен в применении и легко поддается автоматизации.
9. Измерение какого свойства лежит в основе кондуктометрического анализа?
Кондуктометрический метод анализа основан на измерении электропроводности (величины, обратной электрическому сопротивлению R) анализируемого раствора.
10. Как практически определяют концентрацию методом прямой кондуктометрии?
Метод прямой кондуктометрии основан на измерении электропроводности анализируемого раствора. Концентрацию определяемого компонента находят по калибровочному графику, устанавливающему связь между концентрацией вещества в растворе и его электропроводностью. Для построения калибровочного графика необходимо точно воспроизвести солевой состав анализируемой пробы или доказать отсутствие в ней примесей.
Электропроводность растет с увеличением концентрации электролита (в области разбавленных и умеренно концентрированных растворов).
Концентрацию вещества в анализируемом растворе определяют по результатам измерений удельной электропроводности этого раствора.
Удельную электропроводностьκ определяют экспериментально на основании измерения электрического сопротивления термостатированной кондуктометрической ячейки.


