Файл: Учебное пособие по химии для студентов i курса факультета всо оренбург, 2016 удк 54(075. 8) Ббк 24я73 у 91.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 186
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Магний и кальций являются антагонистами. Ионы кальция подавляют активность многих ферментов, активизируемых ионами магния. Антагонизм ионов кальция и магния проявляется еще и в том, что ион кальция является внеклеточным ионом. При длительном поступлении в организм избыточных количеств солей магния наблюдается усиленное выделение кальция из костной ткани.
Биологическая роль йода, брома
Вначале недостаток йода в организме приводит лишь к небольшому увеличению щитовидной железы, но, прогрессируя, эта болезнь поражает многие системы организма. Прежде всего, снижается активность щитовидной железы (гипотиреоз); наблюдаются нарушения в обмене веществ, замедляется и ослабляется сердечная деятельность, понижается артериальное давление, возникает общая слабость и апатия. Вместе с этим происходит уменьшение "сгорания" жиров, увеличивается содержание холестерина в крови и развивается отек соединительной ткани, наблюдается шелушение кожи и выпадение волос. Наибольшее распространение эта болезнь получила в горных районах и местностях сильно удаленных от моря.
Болезнь может возникнуть в любом возрасте. В раннем она затрудняет нормальный рост, наблюдается отставание физического и психического развития (кретинизм). В зрелом возрасте болезнь ускоряет наступление атеросклероза и старости.
Повышение содержания бромид-ионов в крови нарушает это равновесие и, согласно принципу Ле-Шателье, наступает быстрое выделение почками хлорид-ионов, а при избытке хлорид-ионов, наоборот, выделяются из организма бромид-ионы. Поэтому, большой избыток принятого хлорида натрия увеличивает скорость выделения из организма бромид-ионов, что используется при отравлении солями брома.
Биологическая роль хрома
Хром относится к биогенным элементам. Как установлено, он играет важную роль в процессе метаболизма углеводов, осуществляя, по-видимому, связывание инсулина с рецепторами клеточных мембран. С этим согласуется тот факт, что обычное содержание хрома в сыворотке крови, которое составляет приблизительно 0,03 ммоль резко снижается при введении в кровь глюкозы.
Биологическая роль марганца и его соединений
Марганец является важным биогенным элементом. Недостаток марганца в организме приводит к заболеваниям: развивается дегенерация яичников и семенников, происходит укорочение и искривление конечностей и другие деформации скелета. В хрящах понижается содержание галактозамина. В организме марганец образует комплексы с белками, нуклеиновыми и аминокислотами. Эти комплексы входят в состав металлоферментов - аргиназы, холинэстеразы, пируваткарбоксилазы и др. Аргиназа - фермент катализирующий
превращение в мочевину аминокислоты - аргинина, входящей в состав белков. Холинэстераза - фермент крови, образуется в печени, участвует в процессе свертывания крови. Марганец участвует в таком жизненно важном процессе, как аккумуляция и перенос энергии. В организме человека биохимическим аккумулятором и переносчиком энергии являются системы АТФ и АДФ, которые в клетках находятся в виде комплексных ионов [MnАТФ]2-. Схематично перенос концевой фосфатной группы можно представить так:
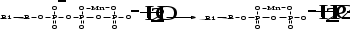
В процессе гидролиза [MnАТФ]2- до [MnАДФ]- выделяется большое количество энергии, за счет которой осуществляется синтез белков. Марганец усиливает действие гормонов, в том числе инсулина, а также действие ферментов, участвующих в процессах кроветворения. Суточная потребность марганца составляет 5-7 мг, она полностью удовлетворяется продуктами, которые человек употребляет в пищу. Больше всего марганца содержится в картофеле, моркови, красной свекле, печени, чае.
Биологическая роль железа и его соединений.
Функции железа в живых организмах многочисленны и разнообразны. В организме человека содержится 3-5 г железа, из них 70% сосредоточено в эритроцитах, что составляет 20мМ; в остальных тканях железа лишь 0,3мМ. Суточный рацион человека соcтавляет 15 мг железа, из них организм усваивает 1 мг. Железо в эритроцитах находится в виде внутрикомплексного соединения - гемоглобина. Гемоглобин в свою очередь включает белковую часть глобин (Гл) и простетичскую небелковую группу - гем, на долю которой приходится 4% массы гемоглобина. Гем представляет собой хелатный комплекс железа (II) с порфирином:
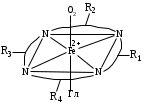
Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям:
HbFe2+ + O2 HbFe2+• O2
дезоксигемоглобин оксигемоглобин
Гемоглобин может взаимодействовать также с оксидом углерода (П), образуя более прочный комплекс, чем гем с кислородом:
HbFe2++CO HbFe2+• CO
карбоксигемоглобин
Для смещения равновесия влево необходимо увеличить парциальное давление кислорода.
Существуют гемовые ферменты - цитохромы, которые содержат железо со степенью окисления +3. Это каталаза и пероксидаза. Каталаза выполняет защитные функции, катализируя распад H2O2:
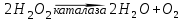
и препятствует накоплению H2O2, который оказывает повреждающее действие на компоненты клеток. Пероксидаза выполняет ту же функцию, но действует значительно медленнее, примерно в 104 раз. Недостаток железа в организме нарушает синтез гемоглобина и железосодержащих ферментов, что приводит к тяжелому заболеванию - гипохромной анемии.
Бионеорганические комплексы d-элементов с белковыми молекулами называют биокластерами. Внутри биокластера находится полость, в которой находится ион металла определенного размера, размер иона должен точно совпадать с диаметром полости биокластера. Металл взаимодействует с донорными атомами связующих групп: гидроксильные –ОН¯, сульфгидрильные –SH¯, карбоксильные –СОО¯, аминогруппы белков или аминокислот – NH2.
Биокластеры, полости которых образуют центры ферментов, называют металлоферментами.
В зависимости от выполняемой функции биокластеры условно подразделяют на:
- транспортные, доставляют организму кислород и биометаллы. Хорошими транспортными формами м/б комплексы металлов с АМК. В качестве координирующего металла могут выступать: Со, Ni, Zn, Fe. Например – трансферрин.
- аккумуляторные, накопительные. Например – миоглобин и ферритин.
- биокатализаторы и активаторы инертных процессов.
Реакции, катализируемые этими ферментами подразделяются на:
Кислотно-основные реакции. Карбоангидраза катализирует процесс обратимой гидратации CO2 в живых организмах.
Окислительно-восстановительные.
Катализируются металлоферментами, в которых металл обратимо изменяет степень окисления.
Карбоангидраза, карбоксипептидаза, алкогольдегидрогеназа.
Карбоангидраза – Zn содержащий фермент. Фермент крови, содержится в эритроцитах. Карбоангидраза катализирует процесс обратимой гидратации CO2, также катализирует реакции гидролиза, в которых участвует карбоксильная группа субстрата.
Н2О + СО2 ↔ Н2СО3 ↔ Н+ + НСО3¯ («цинк-вода»)
ОН¯ + СО2 ↔ НСО3¯ («цинк-гидроксид»)
Координационное число цинка 4. Три координационные места заняты аминокислотами, четвертая орбиталь связывает воду или гидроксильную группу.
Механизм действия:
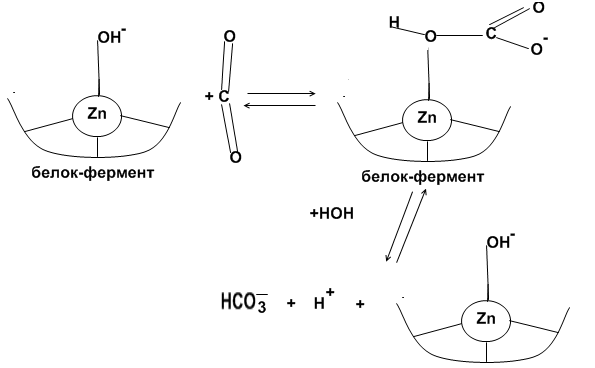
Обратимая гидратация CO2 в активном центре карбоангидразы
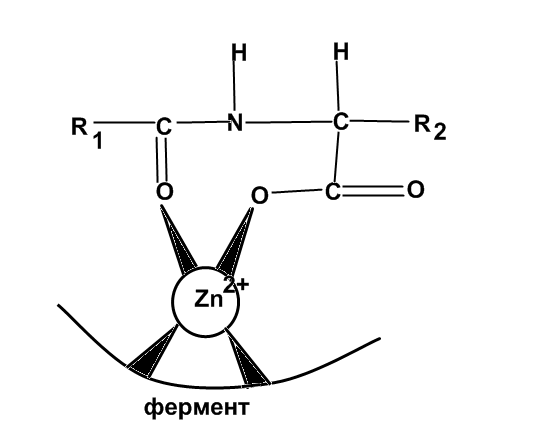
Карбоксипептидаза Zn содержащий фермент. Объектами концентрации являются печень, кишечник, поджелудочная железа.
Участвует в реакциях гидролиза пептидных связей.
Схема взаимодействия цинка карбоксипептидазы с субстратом («цинк-карбонил»):
Цитохромы, каталаза, пероксидаза.
Цитохром С. - гемсодержащий фермент, имеет октаэдрическое строение.
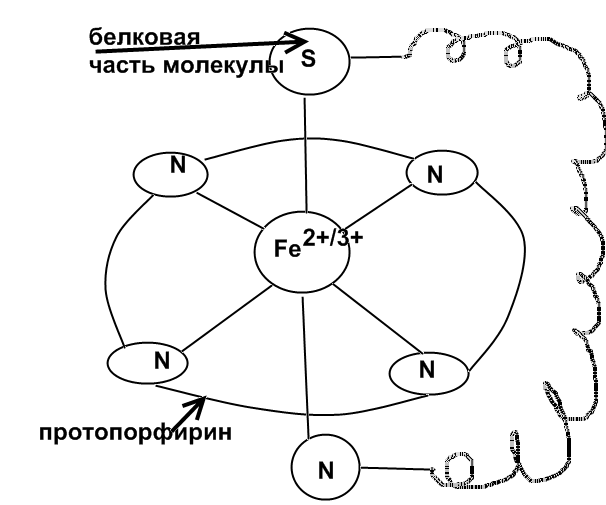
Перенос электронов в окислительно-восстановительной цепи с участием этого фермента осуществляется за счет изменения состояния железа:
ЦХ • Fe3+ + ẽ ↔ ЦХFe2+
Группы ферментов, катализирующие реакции окисления водородпероксидом, называются каталазами и пероксидазами. Они имеют в своей структуре гем, центральный атомом является Fe3+. Лигандное окружение в случае каталазы представлено АМК (гистидин, тирозин), в случае пероксидазы – лигандами являются белки. Концентрируются ферменты в крови и в тканях.
Каталаза ускоряет разложение пероксида водорода, образующегося в результате реакций метаболизма:
Н2О2 + Н2О2 ↔каталаза↔ 2 Н2О + О2
Фермент пероксидаза ускоряет реакции окисления органических веществ (RH) пероксидом водорода:
Н2О2 + Н2О*RH ↔пероксидаза↔ 2 Н2О + RCOOH
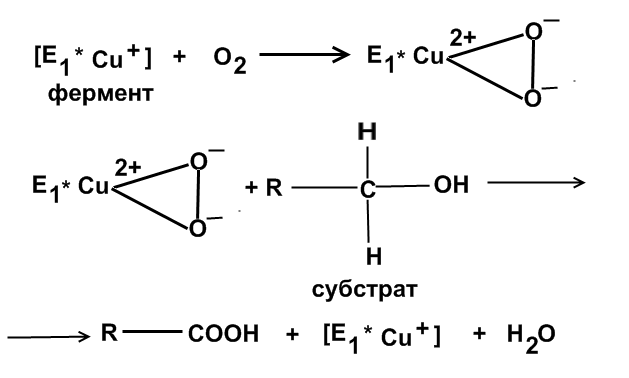
Оксигеназы.
ОКГ – оксигеназы – ферменты, активирующие молекулу кислорода, которая участвует в процессе окисления органических соединений. Оксигеназы присоединяют оба атома кислорода с образованием пероксидной цепочки. Механизм действия оксигеназ можно представить следующим образом:
VIII. Упражнения
-
Аналитические реакции катионов d-элементов:
а) на Cu2+ с избытком гидроксида аммония,
б) на Cr3+ с пероксидом водорода в щелочной среде при нагревании,
в) на Mn2+ со щавелевой кислотой,
г) на Zn2+ со щелочами,
д) на Fe3+ с гексацианоферратом (II) калия,
е) на Fe3+ с тиоцианатом калия,
ж) на Fe2+ с гексацианоферратом (III) калия,
Укажите эффект реакций.
В окислительно-восстановительных реакциях коэффициенты расставляются с применением метода электронного баланса.
-
Аналитические реакции анионов и катионов р-элементов:
а) СN– (с нитратом серебра),
б) Pb+2 (с хроматом калия),
в) NО2– (с перманганатом калия в кислой среде),
г) NО3– (с медью и серной кислотой),
д) РО43– (с нитратом серебра),


