Файл: Учебное пособие по химии для студентов i курса факультета всо оренбург, 2016 удк 54(075. 8) Ббк 24я73 у 91.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 175
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
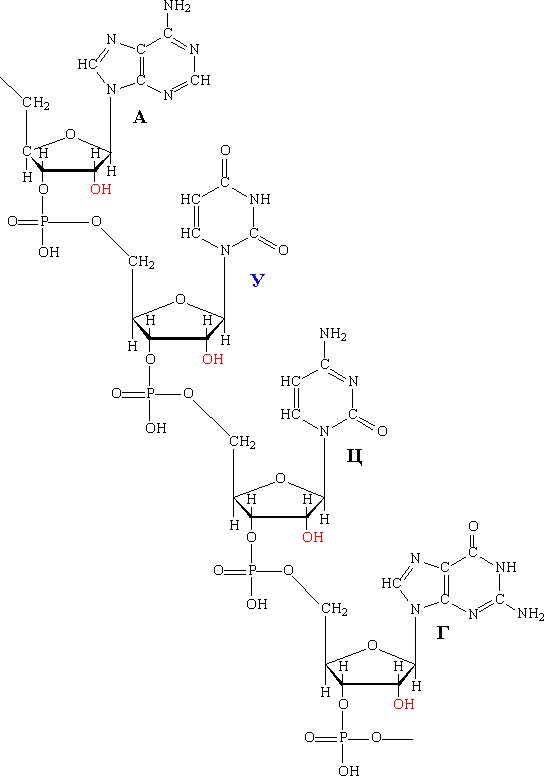
Вторичная структура РНК
Вторичная структура РНК – отдельные участки цепей РНК образуют спирализованные петли – «шпильки» за счет водородных связей между комплементарными парами азотистых оснований А=У, Г=Ц, но в составе РНК встречаются не спаренные нуклеотидные остатки или даже одноцепочные петли, не вписывающие в двойную спираль.
Третичная структура РНК
Третичная структура РНК – характеризуется компактной, упорядоченной структурой путем взаимодействия элементов вторичной структуры, стабилизируется ионами Mg++, характерные для рРНК.
иРНК (информационная РНК) – информационная последовательность нуклеотидных остатков в молекуле несет информацию о синтезе специфического белка непосредственно на ней самой, а также информацию о времени, количестве, месте и условиях синтеза этого белка. иРНК составляет 5% от всех РНК в клетке имеет линейную структуру, содержит большое количество нуклеотидов 5´ конец иРНК содержит КЭП – конец (модифицированный нуклеотид 7-метилгуанозин 5 трифосфат), 3´ конец защищен полиадениловым фрагментом (100-200 остатков). В структуре иРНК заложен триплетный биологический генетический код.
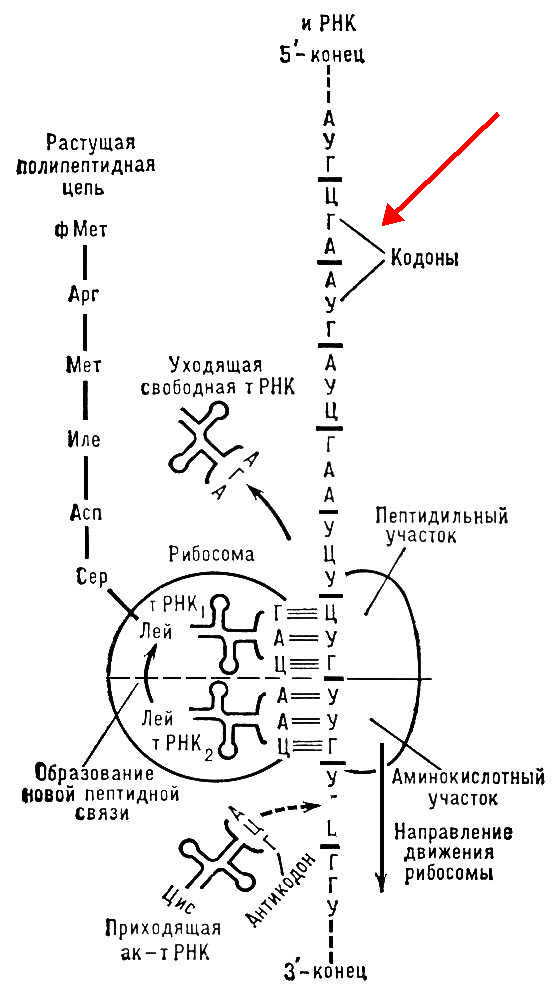
тРНК – главной функцией тРНК является акцентирование аминокислот и перенос их в рибосомы. Последовательность тРНК включает 70-90 нуклеотидов. Общее количество тРНК а клетке состовляет 10%, в составе структуры тРНК имеются минорные (метилированные) азотистые основания, выполняющие две функции: обеспечивают устойчивость тРНК к действию ферментов нуклеаз, поддерживают структуру тРНК. тРНК представлена в форме «клеверного листа» или форме «Г-образной трубки»

Схема взаимодействия тРНК с аминокислотой

Рибосомальные РНК (рРНК)
Рибосомальные РНК являются структурной основой для формирования рибонуклеопротеина – субъединицам рибосом. Каждая рибосома состоит из рРНК и белка. Масса от всех видов РНК составляет 80-85%. В малой субъединице рибосомы находится одна молекула рРНК, в большой субъединице две молекулы рРНК и около 60% белка. В большой субъединице рРНК выполняют роль катализаторов- рибозимов, образуя транспентидазный и транслоказный центры, выполняя функции в образовании пептидной связи и перемещение рибосом по иРНК.
При гидролизе ДНК и РНК под действием РНКазы, ДНКазы идет постепенный разрыв 3´-5´ фосфодиэфирных связей, при этом образуются сначало олигонуклеотиды, затем динуклеотиды и далее мононуклеотиды. Катаболизм пуриновых и пиримидиновых нуклеотидов идет по разному в результате распада пуриновых нуклеотидов образуется мочевая кислота, а при распаде пиримидиновых – мочевина и β – аланин.
Схема гидролиза пуриновых нуклеотидов ( на примере АМФ)
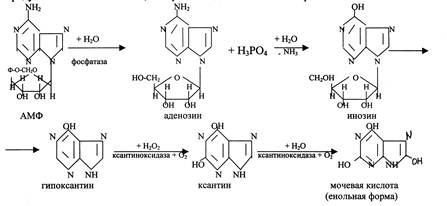
Мочевая кислота выводится из организма 25% через кишечник, 75% через почки. Для мочевой кислоты характерна кето-енольная таутомерия.

Схема гидролиза пиримидиновых оснований (на примере ЦМФ)

Мочевина выводится через почки, а β-аланин идет на синтез кофактора HSCoA.
VШ. Упражнения
1. Приведите строение кофактора НАД+ и НАДНН+.
2. Напишите уравнение реакции превращения яблочной кислоты в щавелевоуксусную с участием кофермента НАД+.
3. Напишите строение макроэргов: АТФ, ГТФ обозначьте макроэргические связи в этих соединениях.
4. Приведите строение нуклеотидов, входящих в состав РНК, ДНК. Назовите их, укажите гликозидную и сложноэфирную связь, выделите азотистые основания, пентозы.
5. Напишите уравнения реакции:
А) фосфорилирования: цитидина, д- аденозина;
Б) полного гидролиза: д- АМФ;
В) неполного гидролиза ТМФ;
6. Приведите строение циклических нуклеотидов: цАМФ; цГМФ
7. Напишите динуклеотид состоящий из дАМФ и дЦМФ, покажите 5´ и 3´ свободный конец.
8. Приведите строение: тимина, цитозина и комплементарных им оснований;
9. Напишите уравнение реакции: взаимодействия аденозина с азотистой кислотой. Назовите полученный продукт.
IX. Рекомендуемая литература:
а) основная учебная литература
1. Пузаков С.А. Химия: учебник для факультета ВСО – М.: ГЭОТАР-Медиа, 2006 – 640 с.
2. Пузаков С.А. Химия [Электронный ресурс] / Пузаков С.А., 2006 г , ГЭОТАР-Медиа « Консультант студент»
б) дополнительная учебная литература
1. Тюкавкина, Н. А. Биоорганическая химия: учебник / Н. А. Тюкавкина, Ю.И. Бауков, С. Э. Зурабян. - М.: ГЭОТАР-Медиа, 2009. - 416 с
2. Тюкавкина Нонна Арсеньевна Биоорганическая химия [Электронный ресурс] / Тюкавкина Нонна Арсеньевна, 2012 г , ГЭОТАР-Медиа « Консультант студент»
3. Материалы лекций
Занятие №11
I.Тема 11: Растворы ВМС. Свойства биополимеров
II. Актуальность темы: Важность темы определяется тем, что на основании На основании закономерностей растворение растворов ВМС можно объяснить механизм действия изо-, гипер-, гипотонических растворов, применяемых в медицинской практике, а также рассчитать изотонический коэффициент. Материал данной темы является необходимой базой для изучения отдельных разделов физической, коллоидной химии.
Ш.Цель: Сформировать представление о свойствах растворов ВМС и их значения для жизнедеятельности организма.
VI.Исходный уровень:
1.Понятие о растворах ВМС.
2.Белки, как высокомолекулярные соединения.
V.Учебно-целевые вопросы к занятию
-
Свойства растворов ВМС. Особенности растворения ВМС как следствие их структуры. Форма макромолекул. -
Механизм набухания и растворения ВМС. Факторы, влияющие на набухание: температура, рН, электролиты. -
Аномальная вязкость растворов ВМС. Уравнение Штаудингера. Вязкость крови. -
Осмотическое давление растворов биополимеров. Уравнение Галлера. Онкотическое давление плазмы крови. -
Полиэлектролиты. Изоэлектрическая точка и методы ее определения. -
Устойчивость растворов биополимеров. Высаливание биополимеров из растворов: определение, механизм и факторы, определяющие этот процесс (температура, электролиты, неэлектролиты). -
Застудневание растворов ВМС: механизм и факторы процесса (форма макромолекул, температура, концентрация, рН, электролиты). Свойства студней: тиксотропия и синерезис.
VI. После изучения темы студент должен
знать:
- суть коллигативных свойств растворов: диффузии, осмоса,;
- сущность терминов: изотонический, гипертонический, гипотонический раствор;
- сущность процессов высаливания, набухания и растворения;
- суть понятия аномальной вязкости и её значение для функционирования живого организма;
- суть застудневание растворов ВМС, свойства студней: тиксотропия и синерезис.
уметь:
- производить вычисления изотонического коэффициента
- проводить сравнительный анализ механизма растворения и набухания растворов для определения их действия как изотонических, гипертонических или гипотонических;
- проводить расчеты значений осмотического давления биополимеров
VII. Теоретический материал
Механизм набухания и растворения ВМС. Факторы, влияющие на набухание: температура, рН, электролиты.
РАСТВОРЕНИЕ ВМС
Растворение высокомолекулярных веществ принято рассматривать как процесс, аналогичный смешению двух жидкостей, в котором имеет значение как энергетическое взаимодействие между молекулами растворяемого вещества и растворителя (энергетический фактор), так и действие фактора, обусловливающего равномерное распределение молекул растворенного вещества в растворе (энтропийный фактор).
Самопроизвольное растворение ВМС, равно как и всяких других веществ, должно сопровождаться уменьшением изобарного термодинамического потенциала. Согласно химической термодинамике
G = H – T S,
Где G - изобарно-изотермический потенциал; Н - теплосодержание или энтальпия; Т - абсолютная температура; S - энтропия.
Очевидно, чтобы уменьшился термодинамический потенциал и произошло самопроизвольное растворение высокополимера, изобарно-изотермический потенциал должен иметь отрицательное значение. Это возможно в двух случаях: а) Н < 0; б) S > 0. Первое условие (Н < 0) выполняется только тогда, когда растворение сопровождается выделением тепла системой. Это происходит в тех случаях, когда энергия образования сольватных оболочек из растворителя вокруг макромолекул больше количества энергии, необходимого для разрыва связей как между молекулами растворяемого вещества, так и молекулами растворителя.
Второе условие (S > 0) при растворении выполняется всегда, так как энтропия смешения, как правило, положительна. Исследования, произведенные в последние годы, показали, что при растворении высокополимеров энтропия смешения обычно значительно превышает идеальную энтропию. Это объясняется тем, что при растворении высокополимеров возрастает возможность движения в растворе отдельных участков (сегментов) гибких цепных молекул, причем, каждая может осуществлять большое число конфигураций. В предельно разбавленном растворе, когда макромолекулы будут находиться на значительном расстояниях друг от друга, они могут практически принимать любые конфигурации. Таким образом, при растворении ВМС система переходит из менее вероятного в более вероятное состояние и соответственно вероятностная функция, характеризующая процесс (энтропия), должна возрастать.
Благодаря аномально большим значениям энтропии, при растворении многих высокополимеров энтропийный фактор играет решающую роль, особенно при растворении полимеров с неполярными молекулами, когда растворение сопровождается поглощением тепла (Н > 0).
Первой стадией растворения высокомолекулярных веществ с линейными молекулами, в отличие от растворения низкомолекулярных веществ, является набухание. При набухании высокополимер поглощает низкомолекулярный растворитель, значительно увеличивается в весе и в объеме без потери микроскопической однородности. Объем ВМС при набухании может увеличиваться до 1000-1500 %.


