Файл: Учебное пособие по химии для студентов i курса факультета всо оренбург, 2016 удк 54(075. 8) Ббк 24я73 у 91.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 241
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
-
П = i • C • R • T
i
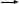 = 1 + α (n – 1) NaCl Na+ + Cl-
= 1 + α (n – 1) NaCl Na+ + Cl-n = 2
-
В разбавленных растворах сильных электролитов α → 1
i = 1 + 1(2 -1) = 2
-
Возьмем V р-ра = 100мл NaCl -
m(р-ра) = V • p = 100мл • 1г/мл = 100г -
m(NaCl) = m(р-ра) • ω% = 100г • 0,4% = 0,4г
100% 100%
-
С(NaCl) =m = 0,4г = 0,068моль/л
M • V р-ра 58,5г/мл • 0,1л
-
П = 2 • 0,068моль/л • 8,31 л • кПа • 310К = 350,3кПа
моль • К
Ответ: а
Задача 4
Моляльная концентрация (моль/кг) раствора NaOH, температура кипения которого 102,650С и степень диссоциации NaOH α = 70%, будет равна:
а) 4,5 б) 3,0 в) 2,0 г) 5,5
Р
 ешение:
ешение:-
 Тк = tк = 102,650С – 1000С = 2,650С = 2,65К
Тк = tк = 102,650С – 1000С = 2,650С = 2,65К -
N aOH Na+ + OH- n = 2
aOH Na+ + OH- n = 2
 Тк = i • Кэ • В(NaOH)
Тк = i • Кэ • В(NaOH)-
В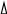 (NaOH) = Тк__
(NaOH) = Тк__
i • Кэ
-
i = 1 + α (n – 1) = 1 + 0,7 (2 – 1) = 1,7 -
В(NaOH) = 2,65К = 2,65моль/кг = 3,0моль/кг
1,7 • 0,52кг • К/моль 0,884
Ответ: б
Задача 5
Концентрация уксусной кислоты (моль/л) в растворе со степенью диссоциации СН2СООН 0,01 и Кд = 1,80 • 10-5моль/л равна:
а) 0,25 б) 0,18 в) 0,38 г) 0,45
Решение:
α = √Кд α2 = Кд
С С
С = Кд = 1,8 • 10-5моль/л = 1,8 • 10-5 моль/л = 1,8 • 10-1 = 0,18моль/л
α2 (10-2)2 10-4
Ответ: б
Ситуационные задачи
«Способы выражения концентрации растворов»
Задача №1
Раствор сульфата цинка с массовой долей 0,5% применяют как антисептическое и вяжущее средство.
Вопросы:
1.Что называется массовой долей раствора?
2.Какая масса сульфата цинка и воды требуется для приготовления 1 кг данного раствора?
3.Чему равен объем полученного раствора, если его плотность 1,01 г/мл?
4.Является ли полученный раствор насыщенным?
5.Какую массу цинкового купороса ZnSO4∙7H2O необходимо взять для приготовления 1 кг 0,5% раствора сульфата цинка?
Задача №2
В качестве средства скорой помощи для выведения больных из обморочного состояния используют нашатырный спирт 10% раствор аммиака. В лаборатории имеется 25% раствор аммиака плотностью 0,907 г/мл.
Вопросы:
1.Какой способ использован для выражения количественного содержания аммиака в растворе?
2. Как формулируется определение этого вида концентрации?
3. Чему равна масса аммиака в 0,5 л 10% раствора плотностью 0,958 г/мл?
4. Каким образом из 25% раствора аммиака можно приготовить нашатырный спирт?
5. Чему равен объем 25% раствора аммиака, который необходимо взять для приготовления 0,5 л нашатырного спирта?
Задача №3
Для приготовления лекарственных настоек используется 40% раствор этилового спирта. В лаборатории имеется 96% раствор этилового спирта плотностью 0,81 г/мл.
Вопросы:
1. Что называется истинным раствором?
2. Как можно из 96% раствора этилового спирта приготовить 40% раствор?
3. Какая масса этилового спирта и воды содержится в 1 кг 40% раствора?
4. Какой объем 96% раствора следует взять для приготовления 1 кг 40% раствора этилового спирта?
5. Какой объем воды требуется для приготовления этого раствора?
Задача №4
При недостатке кальция в организме назначают внутрь 10% раствор хлорида кальция плотностью 1,07 г/мл.
Вопросы:
1.Можно ли вместо хлорида кальция использовать карбонат или сульфат кальция?
2.Какой способ выражения концентрации раствора использован для характеристики количественного содержания кальция в растворе?
3.Какая масса хлорида кальция содержится в 100 мл такого раствора?
4.Какую массу кальция можно ввести в организм со 100 мл такого раствора?
5.Какой объем такого раствора можно приготовить из 100 г кристаллогидрата CaCl2∙6H2O?
IX. Литература для самоподготовки:
а) основная учебная литература
1.Пузаков С.А. Химия: учебник для факультета ВСО – М.: ГЭОТАР-Медиа, 2006 – 640 с.
2.Пузаков С.А. Химия [Электронный ресурс] / Пузаков С.А., 2006 г, ГЭОТАР-Медиа «Консультант студент»
б) дополнительная учебная литература
1.Жолнин А. В. Общая химия [Электронный ресурс] / А. В. Жолнин, 2012 г, ГЭОТАР-Медиа «Консультант студент»
2.Ершов Ю. А. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов / Ю. А. Ершов, В. А. Попков, А. С. Берлянд; ред. Ю. А. Ершов, 2015, Юрайт. - 560 с
3.Попков В.А. Общая химия [Электронный ресурс] / Попков В.А., 2010, ГЭОТАР-Медиа «Консультант студент»
4.Материалы лекций.
ЗАНЯТИЕ №2
I.Тема 2: Буферные системы и их роль в организме человека
II. Актуальность темы: В процессе жизнедеятельности в организм поступают извне, а также образуются в результате метаболизма продукты, имеющие как кислый, так и основной характер, однако в норме они не изменяют рН внутренней среды благодаря защитным механизмам, регулирующим кислотно-основное равновесие. Различают физиологические и физико-химические механизмы регуляции кислотного-основного равновесия в организме.
В основе физиологических механизмов регуляции кислотно-основного равновесия лежат процессы метаболизма, дыхания и мочевыделения, которые изучаются в курсах биохимии, нормальной физиологии, патологической физиологии. В основе физико-химических механизмов лежит поддержание постоянства рН внутренней среды буферными системами организма, которые представлены буферными системами крови, клеток и внеклеточных пространств тканей.
III. Цель: Сформировать представление о буферных системах и их значения для жизнедеятельности организма.
IV. Исходный уровень:
1.Понятие о слабых и сильных электролитах.
2.Реакции ионного обмена.
V.Учебно-целевые вопросы:
1.Основные определения: буферные системы, компоненты буферной системы.
2.Механизм действия компонентов буферных систем при поддержании рН.
3.Буферные системы крови.
4.Классификация буферных систем.
5.Расчет рН буферных систем.
6.Буферная емкость и факторы, влияющие на неё.
7. Понятие кислотно-основного состояния и его нарушение: алкалоз, ацидоз
VI. После изучения темы студент должен
знать:
- суть механизма действия буферных систем;
- буферные системы крови;
- сущность механизма действия гемоглобин-оксигемоглобин буферной системы;
- сущность кислотно-основного состояния и его нарушения
уметь:
- производить вычисления по определению рН буферных систем;
- проводить расчеты значений рН, рОН и концентрации ионов водорода (гидроксония)
владеть
- навыками приготовления буферных растворов (ацетатного и фосфатного).
VII. Теоретический материал
Буферные растворы.
Буферные растворы обладают свойствами противодействовать изменению рН как при добавлении кислот и щелочей. Так и при разбавлении.
Буферные растворы, как правило, состоят из:
-
Слабой кислоты и соли этой кислоты и сильного основания (СН3СООН + СН3СООNa) -
Слабого основания и соли этого основания и сильной кислоты (NH4OH и NH4Cl) -
Cмеси солей кислых или средних и кислых (NaH2PO4 и Na2HPO4; NaHCO3 и Na2CO3)
Концентрацию [Н+] в буферном растворе, состоящем из слабой кислоты и ее соли определяем по формуле:
[Н+] = Кк • [к-та]
[соль] (1)
а рН по формуле Гендерсона-Гассельбаха получаем из уравнения
рН = рКк + lg [соль]
[к-та] (2)
рК – показатель константы диссоциации слабого электролита (кислоты)
[соль] – концентрация соли в буферном растворе, моль/л
[к-та] – концентрация кислоты в буферном растворе, моль/л
Для буферных растворов, состоящих из слабого основания и его соли:
[ОН-] = Ко [основ.] (3)
[соль]
рН = 14 – рКо – lg [соль]
[основ] (4)
или рН = 14 – рКо + lg [основ]
[соль] (5)
рКо – показатель константы диссоциации слабого электролита (основание)
[основ] – концентрация основания в буферном растворе, моль/л
В уравнениях (2, 4, 5) вместо концентраций можно использовать количества компонентов, участвующих в образовании буферной системы.
рН = рКк + lg nсоли
nк-ты
рН = 14 – рКо – lg nсоли
nосн
рН = 14 – рКо + lg nосн
nсоли
nсоли = Сс • Vc; nk = Ck • Vk; nосн = Сосн • Vосн
если nc = nk , то выражение (2, 4,5) будет:
рН = рКк + lg Vc (6)
Vk
рН = 14 – рКо – lg Vc (7)
Vосн.
рН = 14 – рКо + lg Vосн (8)
Vc
Буферная емкость – определяется числом моль эквивалентов сильной кислоты или щелочи, которые необходимо добавить к 1л буферного раствора, чтобы изменить его рН на единицу.

n I
Вк = ___
 | рН| • Vб.с.
| рН| • Vб.с. n I щ
n I щВщ = ___
 | рН| • Vб.с.
| рН| • Vб.с. г
 де n I_x - количество эквивалентов сильного электролита
де n I_x - количество эквивалентов сильного электролитаV – объем электролита (мл, л)
V – объем буферной системы (мл, л)
|
 рН| – разность рН по модулю
рН| – разность рН по модулюКЛАССИФИКАЦИЯ БУФЕРНЫХ СИСТЕМ
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH/СН3СООNa), гидрокарбонатная буферная система (H2CO3 /NaHCO3).
2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3H2O/NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3/Na2CO3), фосфатная буферная система (КН2PO4/К2НPO4).
4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму “белок-кислота” или соответственно в форму “белок-основание”. Образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты; б) слабое “белок- основание” + соль этого слабого основания:
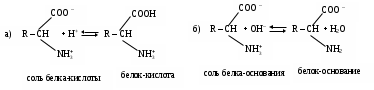
где R - макромолекулярный остаток белка.
Расчет рН буферных систем
Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга.
Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты:
CH3COONa ⇄ Na+ + CH3COO–
CH3
