Файл: Учебное пособие по химии для студентов i курса факультета всо оренбург, 2016 удк 54(075. 8) Ббк 24я73 у 91.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 169
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Энтальпия – это сумма внутренней энергии системы и произведения объема на давление:
Энтальпия – это функция состояния и в термодинамических расчетах используют изменение энтальпии между конченым и начальным состоянием:
где Н1 – энтальпия начального состояния системы;
Н2 – энтальпия конечного состояния системы
Если реакция экзотермическая, то энергия выделяется из системы, что ведет к уменьшению энтальпии, то есть Q> 0, a ΔH< 0. Если реакция эндотермическая – тепло поглощается системой, то есть Q< 0, a ΔH> 0. Таким образом, тепловой эффект реакции Q и энтальпия Н противоположны по знаку:
Из второго закона термодинамики следует, что внутренняя энергия системы состоит как бы из двух частей: свободная энергия – та часть внутренней энергии, которая может быть использована для совершения работы, и связанная энергия – та часть внутренней энергии, которая не используется для совершения работы, а бесполезно рассеивается в виде тепла. Связанная энергия определяется энтропией S, которая равна
Чем больше энтропия, тем больше количество связанной энергии, а чем больше в системе связанной энергии, тем более необратимым является процесс.
С точки зрения статистической термодинамики, энтропию можно рассматривать как меру беспорядка или наиболее вероятного состояния системы:
где W – вероятность существования вещества;
К – постоянная Больцмана:
 ,
,где R – газовая постоянная;
NA – число Авогадро, N
A = 6,02 • 1023 частиц
Энтропия также, как и энтальпия, является функцией состояния, то есть определяется начальным и конечным состоянием.
Энтальпийный и энтропийный факторы. Энергия Гиббса
Самопроизвольное направление реакции определяется действием двух факторов:
1) тенденцией системы к переходу в состояние с меньшей внутренней энергией (энтальпийный фактор);
2) тенденцией к достижению наиболее вероятного состояния, которое достигается переходом системы из более упорядоченного состояния в менее упорядоченное (энтропийный фактор).
Таким образом, движущая сила любого процесса определяется разностью энтальпийного и энтропийного факторов при постоянном давлении и температуре, и называется энергией Гиббса:
где

Знак ΔG определяет направление процесса. При ΔG < 0 процесс идет в прямом направлении , ΔG > 0, процесс идет в обратном направлении, ΔG = 0, условие термодинамического равновесия, при котором в системе не происходит ни энергетических изменений, ни меняется степень беспорядка.
Критерии направления самопроизвольно протекающих процессов
Из уравнения
| № п/п | Знак изменения функции | Возможность самопроизвольного протекания реакции | |||
| ΔН | ΔS | ΔG | |||
| 1 | - | + | - | Возможно при любых Т | |
| 2 | + | - | + | Невозможно при любых Т | |
| 3 | - | - | - | Возможно при низких Т | |
| 4 | + | + | - | Возможно при высоких Т | |
Химическая термодинамика и её применение к биосистемам
В 19 столетии было доказано экспериментально, что первый закон термодинамики применим к процессам, которые происходят в биологических системах.
Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом.
Энергия пищевых продуктов используется в клетках первоначально для синтеза макроэргических соединений - например, аденозинтрифосфорной кислоты (ATФ) . ATФ, в свою очередь, может использоваться как источник энергии почти для всех процессов в клетке.
Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре:
C6H12O6 + 6O2 = 6CO2 + 6H2O
Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (кКал) . Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы.
Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1грамме трех пищевых продуктов (в килокалориях) : углеводы - 4,1; белки - 4,1; жиры - 9,3.
С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую.
Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла.
Другим примером является расход энергии, передаваемой сокращающимся сердцем крови. При течении крови по сосудам вся энергия превращается в тепло вследствие трения между слоями крови и между кровью и стенками сосудов.
Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами.
Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии.
Прямая калориметрия в проведении трудоёмка, поэтому в настоящее время используют метод непрямой калориметрии, который основан на вычислении энергетического выхода организма по использованию им кислорода.
VШ.Задачи:
ЗАДАЧИ С ЭТАЛОНАМИ РЕШЕНИЙ
Задача 1
При сгорании 1 моль ацетилена в кислороде выделилось 1300 кДж теплоты. Определите теплоту образования ацетилена, если стандартные теплоты образовании СО2 (г) и Н2О (ж) равны 393,5 кДж/моль и 286 кДж/моль соответственно.
Решение:
Рассчитываем теплоту образования ацетилена по уравнению:
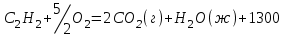 кДж
кДжОтсюда можно записать:
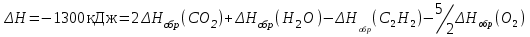
Отсюда находим:
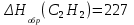 кДж
кДжОтвет: Теплота образования С2Н2 равна 227кДж/моль
Задача 2
При горении формальдегида выделяется 561 кДж тепла. Вычислите теплоту образования формальдегида, если теплота образования СО2 равна 393,6 кДж/моль, а теплота образования Н2О (г) – 242 кДж/моль.
Решение:
По первому следствию из закона Гесса записываем:
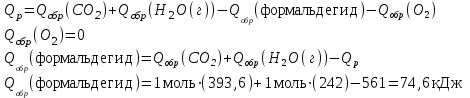
Ответ: Теплота образования формальдегида равна 74,6 кДж/моль
Задача 3
Определите как изменится энтропия в следующей реакции:
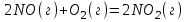 , полученный ответ подтвердите расчетами, если:
, полученный ответ подтвердите расчетами, если: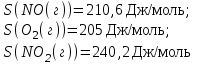
Решение:
ΔS<0, так как в реакции число молей веществ а газообразном состоянии уменьшается, значит энтропия тоже уменьшается(S1>S2).
По первому следствию из закона Гесса:
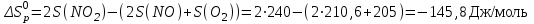
Задача 4
Рассчитаете ΔGреакции
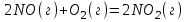 , если
, если 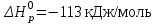 , а
, а  . Возможна ли эта реакция в стандартных условиях?
. Возможна ли эта реакция в стандартных условиях?Решение:
Используем уравнение Гиббса:
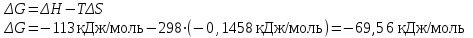
Ответ: ΔG<0, реакция идет в прямом направлении
Задача 5
Повлияет ли изменение температуры (повышение и понижение) на направление протекания реакции, если ΔН<0, S>0. (Проанализируйте уравнение Гиббса)
Решение:
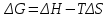
При условии ΔН<0, а ΔS>0 ΔG<0 при любых температурах (при высоких и при низких температурах).
Ситуационные задачи
Термодинамика
Задача №1
Женщина, съела вне плана в составе торта 180 г глюкозы. Считать, что глюкоза полностью окисляется в организме по уравнению:
С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж)
Н0обр (С6Н12О6) = 1273 кДж/моль;
Н0обр (СО2) = 394 кДж/моль;
Н0обр (Н2О) = 286 кДж/моль.
Вопросы:
1.На основании какого закона проводятся термохимические расчеты?
2.По какому уравнению можно рассчитать стандартную энтальпию окисления глюкозы?
3.Каким является процесс окисления глюкозы: экзотермическим или эндотермическим?
4.Какое количество энергии получит организм женщины?
5.Какое время она должна затратить на стирку белья (расход энергии 543 кДж/ч), чтобы компенсировать излишества?


