Файл: Лабораторная работа 18 тема "Определение отношения методом Клемана и Дезорма" Студент гр. Тт22у Дмитриев. Н. С проверил преподаватель.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 16
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство образования и науки Республики Казахстан
"Карагандинский технический университет имени Абылкаса Сагинова"
Кафедра: Физики
ЛАБОРАТОРНАЯ РАБОТА № 18
ТЕМА: "Определение отношения 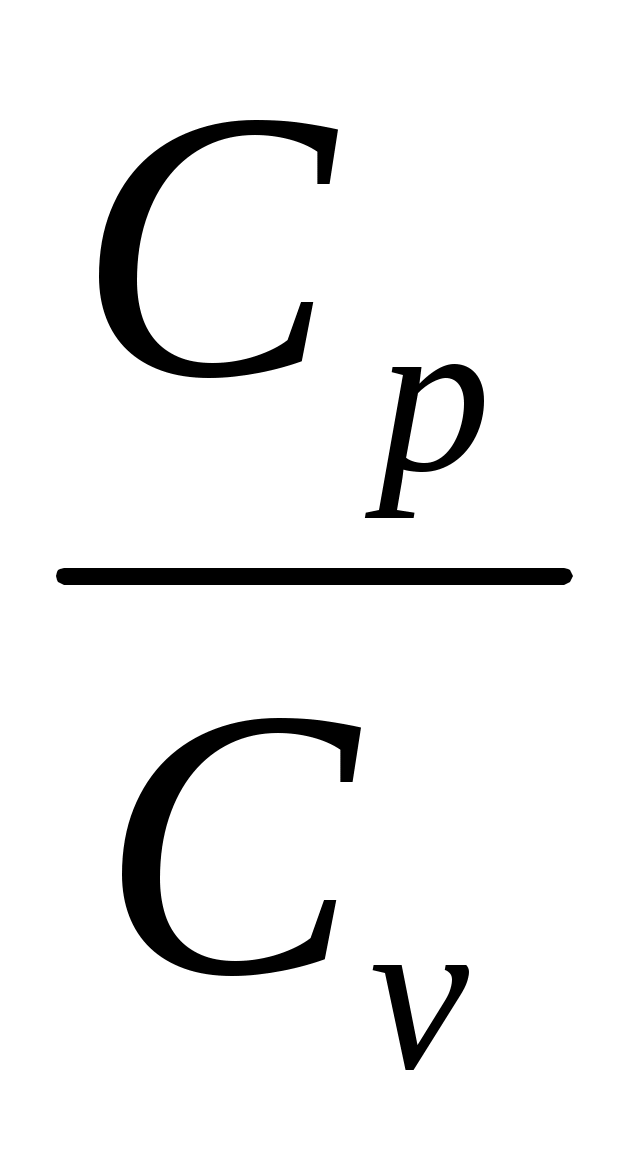 методом Клемана и Дезорма"
методом Клемана и Дезорма"
Выполнил: Студент гр. Тт22у
Дмитриев.Н.С
Проверил: преподаватель
Маженов Нурлан Ахметчанович
Караганда 2023.
Цель работы: Определить экспериментально отношение молярных теплоемкостей газа при постоянном давлении и постоянном объеме и сравнить с теоретическим значением данного отношения, найденным из молекулярно-кинетической теории.
Задачи:
-
овладение одной из методик эксперимента -
приобретение опыта решения учебно-исследовательских и реальных практических задач на основе изученного теоретического материала -
приобретение опыта проведения эксперимента -
формирование навыков обработки результатов проведенных исследований -
формирование умений оформления и представления результатов проведенных исследований -
анализ, обсуждение полученных результатов и формулирование выводов.
Методика работы:
Установка состоит: сосуд А, водяной манометр М, ручной насос.
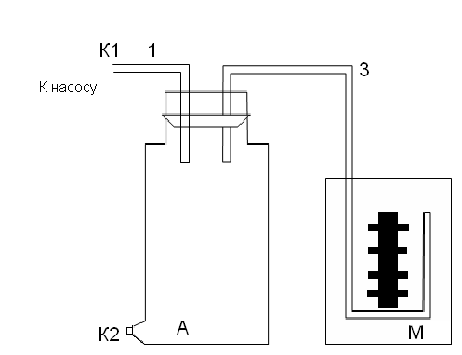
Порядок работы.
1. Открыть зажим
в коленах манометра.
2. Вынуть пробку
3. Вычислить
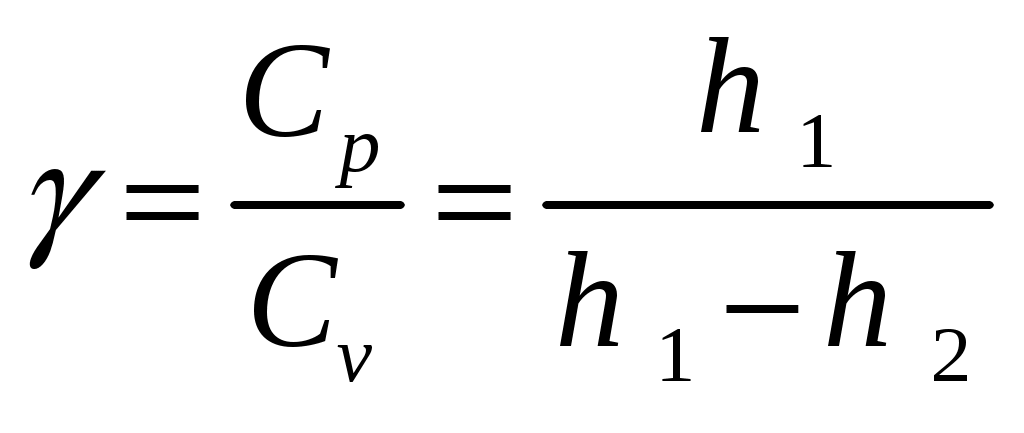 .
.4. Опыт повторить 7 раз. Найти среднее арифметическое значение
среднюю квадратичную ошибку среднего арифметического значения
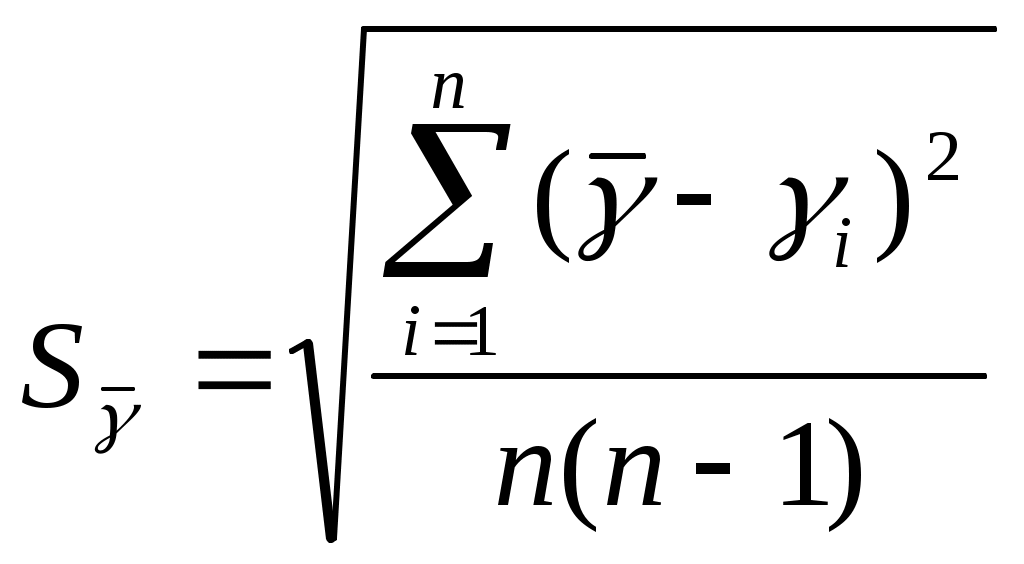 ,
, 5. При доверительной вероятности
Коэффициент
Данные занести в таблицу 1.
Таблица 1.
| № | | | | | | | | |
| 1. | 0,28 | 0,07 | 0,21 | 1.33 | 1.34 | -0,01 | 0,02 | 1.34±0,02 |
| 2. | 0,29 | 0,075 | 0,215 | 1.34 | 0 | |||
| 3. | 0,3 | 0,08 | 0,22 | 1.36 | -0,02 | |||
| 4. | 0,28 | 0,07 | 0,21 | 1.33 | -0,01 | |||
| 5. | 0,31 | 0,085 | 0,225 | 1.37 | 0,03 | |||
| 6. | 0,29 | 0,075 | 0,215 | 1.34 | 0 | |||
| 7. | 0,3 | 0,08 | 0,22 | 1.36 | -0,02 |
Вывод: На данном этапе опыта, было практически освоено содержание теоретического материала и методы измерений в лабораториях кафедры физики при использовании специальных технических средств.
В результате данного опыта были достигнуты цели лабораторной работы и получены следующие результаты в виде:
Анализ:
Данный опыт был проведён с погрешностями, так как измерения производились человеком – присутствовал человеческий фактор, так же имелась инструментальная погрешность в приборах измерения.
Из-за всех этих погрешностей результат опыта не совпадает с теоретическим значением данного отношения, найденным из молекулярно-кинетической теории: γ = 1,34;
Контрольные вопросы.
-
Что называется теплоемкостью тела, удельной теплоемкостью, молярной теплоемкостью?
Теплоёмкость — количество теплоты, поглощаемой (выделяемой) телом в процессе нагревания (остывания) на 1 кельвин. Более точно, теплоёмкость — физическая величина, определяемая как отношение количества теплоты , поглощаемой/выделяемой термодинамической системой при бесконечно малом изменении ее температуры , к величине этого изменения {\displaystyle \mathrm {d} T} Теплоёмкостью
Значение теплоёмкости тела зависит от массы тела, его химического состава, термодинамического состояния и процесса, в котором сообщается теплота
Из определения теплоёмкости следует, что при адиабатном процессе, когда
При изотермическом процессе
понятие теплоёмкости не имеет смысла (
Удельной теплоёмкостью вещества сназывается физическая величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К
Или другое определение удельной теплоёмкости.
Удельной теплоёмкостью вещества называется теплоёмкость единицы массы вещества. Для однородного тела
где
Молярной теплоёмкостью вещества
где
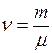 – количество вещества, выражающее число молей.
– количество вещества, выражающее число молей.Или молярной (мольной) теплоёмкостью называется теплоёмкость одного моля вещества
где
Различают теплоёмкости при постоянном объёме и постоянном давлении, если в процессе нагревания вещества его объём или давление поддерживаются постоянным.
Молярная теплоёмкость газа при постоянном объёме
где
– универсальная (молярная) газовая постоянная.
Молярная теплоёмкость газа при постоянном давлении
Молярные теплоёмкости газа
Уравнение (I.61), показывает, что
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение
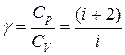 , (I.62)
, (I.62)где
Из формул (I.59) и (I.60) следует, что молярные теплоёмкости определяются лишь числом степеней свободы и не зависят от температуры.
-
Как связаны друг с другом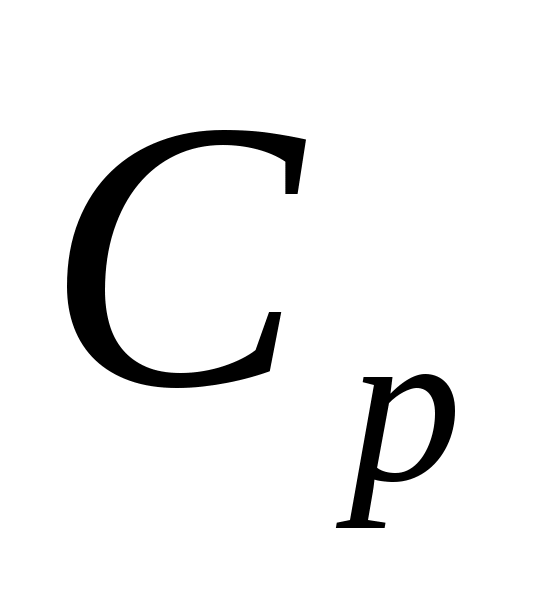 и
и  , что больше и почему?
, что больше и почему?
Сv – теплоемкость при постоянном объеме;
Cp - теплоемкость при постоянном давлении;
Теплоемкость при постоянном давлении Cp бывает больше, чем Сv , потому что при p=const нагреваемое тело расширяется и часть подводимой теплоты расходуется на совершение работы над внешними телами.
