Файл: Лабораторная работа 18 тема "Определение отношения методом Клемана и Дезорма" Студент гр. Тт22у Дмитриев. Н. С проверил преподаватель.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.03.2024
Просмотров: 17
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
У газов, близких по своим свойствам к идеальному газу теплоемкость при постоянном объеме в широких температурных интервалах практически не зависит от температуры: Сv=const.
Cp = Сv + R
Т.о. теплоемкость при постоянном давлении равна сумме теплоемкости при постоянном объеме и газовой постоянной. Но это соотношение справедливо только для идеального газа.
Отношение теплоемкостей
представляет собой характерную для каждого газа величину. Значение
-
Какой процесс называется адиабатическим? Написать уравнение адиабатного процесса (уравнение Пуассона).
. Адиабати́ческий, или адиаба́тный[1] проце́сс (от др.-греч. ἀδιάβατος «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.Перейти к разделу «#Физический смысл адиабатического процесса» Серьёзное исследование адиабатических процессов началось в XVIII веке[2].Перейти к разделу «#История» В целом термин адиабатический в разных областях науки всегда подразумевает сохранение неизменным какого-то параметра. Так в квантовой химии, электронно адибатический процесс это процесс, в котором не изменяется квантовое число электронного состояния. Например, молекула всегда остается в первом возбужденном состоянии вне зависимости от изменения положения атомных ядер. Соответственно неадиабатическим называется процесс, в котором происходит изменение какого-то важного параметраВ термодинамике, адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна[3]. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Равновесный адиабатный процесс является изоэнтропным процессом[4]. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы[5].Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона.Перейти к разделу «#Уравнение Пуассона для идеального газа» Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона. Примером необратимого адиабатического процесса может быть распространение ударной волны в газе. Такой процесс описывается ударной адиабатой. Адиабатическими можно считать процессы в целом ряде явлений природы. Также такие процессы получили ряд применений в технике.
Уравнение Пуассона описывает адиабатный процесс, протекающий в идеальном газе. Адиабатным называют такой процесс, при котором отсутствует теплообмен между рассматриваемой системой и окружающей средой:
Уравнение Пуассона имеет вид:
-
Сформулировать и записать 1-вое начало термодинамики. Что понимают под внутренней энергией: а) реального газа; б) идеального газа.
Пе́рвое нача́ло термодина́мики (первый закон термодинамики) — один из основных законов этой дисциплины, представляющий собой конкретизацию общефизического закона сохранения энергии для термодинамических систем, в которых необходимо учитывать термические, массообменные и химические процессы[1][2][3]. В форме закона сохранения (уравнения баланса энергии) первое начало используют в термодинамике потока и в неравновесной термодинамике. В равновесной термодинамике под первым законом термодинамики обычно подразумевают одно из следствий закона сохранения энергии, из чего проистекает отсутствие единообразия формулировок первого начала, используемых в учебной и научной литературе (К. А. Путилов в своей монографии[4] приводит шесть формулировок, которые он считает наиболее удачными). Внутренняя энергия – это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля). Внутренняя энергия идеального газа определяется кинетической энергией теплового движения молекул и для одного моля вещества выражается формулой
. Поэтому часть внутренней энергии, обусловленной межмолекулярным взаимодействием, может быть вычислена как работа, совершаемая по преодолению сил внутреннего давления т.е.
откуда
Знак минус в этом выражении указывает, что межмолекулярные силы, создающие внутреннее давление, являются силами притяжения. С учетом обеих составляющих внутренняя энергия реального газа выражается в виде
она растет тс повышением температуры и увеличением объема.
Пусть газ из состояния с объемом
Т.е. при адиабатическом расширении без совершения работы внутренняя энергия газа не изменяется. Этот равенство формально справедливо и для идеальных и для реальных газов. Однако физический смысл этого равенства для обоих газов различен. Для идеального газа равенство
получим
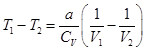 . (2.79)
. (2.79)При расширении V2>V1, поэтому Т1>Т2. Реальный газ при адиабатическом расширении в вакуум охлаждается, при сжатии нагревается.
Внутренняя энергия тела - это полная энергия всех молекул, которые его составляют. Внутренняя энергия идеального газа пропорциональна его температуре.
U = 3/2 · ν · R · T.
Чтобы изменить внутреннюю энергию вещества, надо сообщить ему некоторое количество тепла или совершить работу.
Работа в термодинамике равна изменению внутренней энергии системы: A = ΔU.
Работа газа в изобарном процессе равна A = P · ΔV.
-
Что такое внутренняя энергия? Почему ее называют функцией состояния?
внутренняя энергия – это физическая величина, равная сумме кинетической энергии теплового движения частиц тела и потенциальной энергии их взаимодействия друг с другом. Обозначение – (U) , в СИ единица измерения – Джоуль (Дж). В термодинамике внутренняя энергия зависит от температуры и объема тела. Внутренняя энергия тел зависит от их температуры, массы и агрегатного состояния.
Функция состояния-это свойство, описывающее определенное состояние, независимо от пути, пройденного для достижения этого состояния. Напротив, функции, значение которых зависит от пути, пройденного для перехода между двумя состояниями, называются путями функции.
-
Что такое теплота? Почему ее называют функцией процесса?
. Теплота есть одна из форм передачи энергии от одного тела к другому. В 1842 г. немецкий ученый Р. Майер открыл закон эквивалентности между теплотой и работой, который является частным случаем первого начала термодинамики: взаимное превращение теплоты и работы совершается в строго эквивалентном соотношении:
Обе эти величины должны быть выражены в одинаковых единицах.
Вернёмся к уравнению первого начала термодинамики (6.1). В этом уравнении теплота (
Таким образом, хотя три величины, входящие в уравнение первого начала термодинамики, измеряются в одинаковых единицах, тем не менее, по своим свойствам эти величины глубоко различны.
Теплота и работа зависят от промежуточных состояний рабочего тела в процессе, поэтому должны определяться по формулам, в которых учитывается характер рассматриваемого процесса.
Функции состояния не зависят от промежуточных состояний рабочего тела, поэтому могут подсчитываться по одной общей для них формуле.
-
Определить Сp/СV в зависимости от степеней свободы.
Cv= (i/2)R Cp= ((i+2)/2)R i- число степеней свободы
