Файл: Лабораторная работа 7 Исследование скорости химических реакций и химического равновесия ст группы тх 2 2.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.03.2024
Просмотров: 20
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования

«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей химии
Лабораторная работа №7
«Исследование скорости химических реакций и химического равновесия»
Выполнил: ст. группы ТХ-22-1 / / Мафула Нахя Э/
(должность) (подпись) (Ф.И.О)
Проверил: / /
(должность) (подпись) (Ф.И.О)
Цель работы: изучить зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомиться с влиянием концентрации реагентов на химическое равновесие.
Общие сведения
Средняя скорость реакции равна изменению молярной концентрации реагента в единицу времени при постоянстве объёма системы. Измеряется в СИ в моль/м3∙с. Истинная скорость реакции равна модулю производной концентрации по времени:
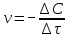
Для одностадийной реакции типа:
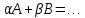
скорость определяется кинетическим уравнением:
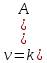
где
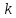 – коэффициент пропорциональности, константа скорости реакции,
– коэффициент пропорциональности, константа скорости реакции, 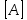 и
и 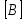 – молярные концентрации реагентов,
– молярные концентрации реагентов,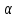 и
и 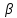 – частные порядки реакции по данным реагента.
– частные порядки реакции по данным реагента.Константа скорости не зависит от времени протекания реакции и концентрации реагентов, но
зависит от природы участников реакции, температуры и присутствия катализатора и имеет физический смысл скорости реакции при единичных концентрациях реагирующих веществ.
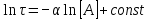
Эмпирическое правило Ван-Гоффа: «При увеличении температуры на 10 К скорость химических реакций возрастает в 2-4 раза»:
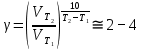
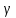 – температурный коэффициент скорости реакции.
– температурный коэффициент скорости реакции.Уравнение Аррениуса, связывающее константу скорости с температурой и энергией активации:
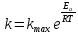 ,
,где R – универсальная газовая постоянная, равная 8,314 Дж/моль∙K;
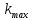 – предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными.
– предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными.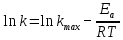
Большинство химических уравнений являются обратимыми, могут протекать как в прямом, так и в обратном направлениях. Рассмотрим обратимую реакцию:
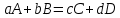
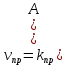
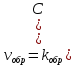
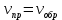
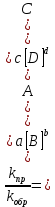
К – константа химического равновесия, которая зависит от температуры и природы реагентов, не зависит от концентрации реагентов.
Смещение равновесия – переход от одного равновесного состояния к другому в результате изменения внешних условий (температуры, давления, добавки одного из реагентов).
На практике важно добиться максимально возможного смещения равновесия в сторону прямой реакции (или обратной, если требуется подавить образование вредных веществ).
Принцип Ле-Шателье: «Равновесие смещается в сторону реакции, ослабляющей оказываемое на систему внешнее воздействие».
Выполнение работы
Опыт 1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде
В четыре сухие пробирки были внесены тиосульфат натрия и вода согласно таблице.
Таблица 1. Приготовления растворов
| Номер пробирки | Число капель | |||
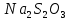 | 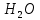 | 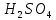 | Всего | |
| 1 | 4 | 8 | 1 | 13 |
| 2 | 8 | 4 | 1 | 13 |
| 3 | 12 | 0 | 1 | 13 |
| 4 (контрольная) | 6 | 7 | 0 | 13 |
В каждую из пробирок (кроме пробирки №4) была добавлена одна капля серной кислоты, и было определено время от момента добавления кислоты (начала реакции) до появления явной мути за счёт образующейся серы.
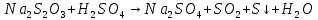
Таблица 2. Зависимость времени реакции от количества тиосульфата натрия
| Номер пробирки | С( 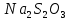 ) (относительные единицы) ) (относительные единицы) | Время реакции τ, с |
| 1 | 1 (4) | 132 |
| 2 | 2 (8/4) | 110 |
| 3 | 3 (12/4) | 91 |
Обработка экспериментальных данных
Таблица 3. Зависимость скорости реакции от концентрации тиосульфата натрия
| Номер пробирки | C( 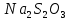 ) (относительные единицы) ) (относительные единицы) | Время реакции τ, с | Условная скорость реакции 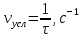 |
| 1 | 1 | 132 | 0,0076 |
| 2 | 2 | 110 | 0,0091 |
| 3 | 3 | 91 | 0,0110 |
По данным таблица был построен график зависимости в координатах

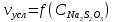
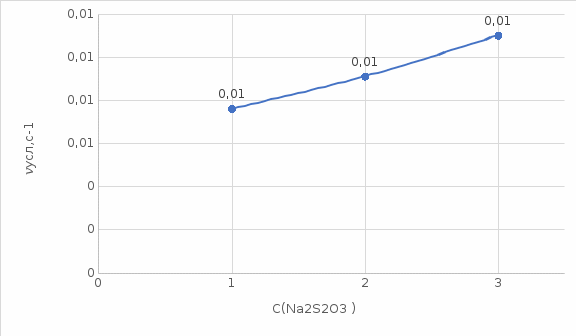
Вывод: С увеличением концентрации тиосульфата натрия скорость его разложения возрастает.
Опыт 2. Влияние температуры на скорость реакцию разложения тиосульфата натрия
В термостат с водой были помещены две пробирки, в одной из которых было 10 капель раствора тиосульфата натрия, а в другой – 10 капель раствора серной кислоты, после чего они были термостатированы, и показания установившейся температуры были зафиксированы. Затем серная кислота из пробирки была прилита к тиосульфату натрия, и было определено время от момента добавления кислоты (начала реакции) до появления явной мути за счёт образующейся серы.
Данные действия были проведены ещё два раза.
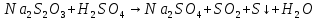
Таблица 4. Зависимость времени реакции от температуры
| № п/п | Температура, °C | Время τ, с |
| 1 | 66 | 14 |
| 2 | 74 | 11 |
| 3 | 89 | 5 |
Обработка экспериментальных данных
Таблица 5. Зависимость скорости реакции от температуры
| № п/п | Температура Т, К | Время реакции τ, с | Условная скорость реакции 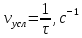 |  | 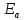 , ,кДж/моль | |
| 1 | 339 | 14 | 0,0714 | 1,354 | 29,639 | |
| | ||||||
| 2 | 347 | 11 | 0,0910 | | ||
| 1,690 | 54,799 | | ||||
| 3 | 362 | 5 | 0,2 | | ||
| |
Значение температурного коэффициента (коэффициента Вант-Гоффа):
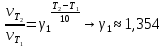
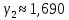
Значение энергии активации:
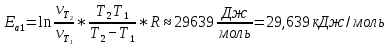
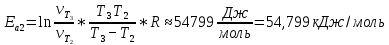
Среднее значение температурного коэффициента (коэффициента Вант-Гоффа):
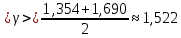
Среднее значение энергии активации:
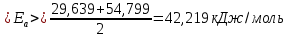
Вывод: С повышением температуры возрастает скорость химических реакций, т. к. увеличивается число активных молекул, а энергия активации снижается.
Опыт 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
Были взяты два небольших приблизительно одинаковых кусочка мела. Один из них был измельчен в порошок и помещён в пробирку, второй кусочек был помещен целиком в другую пробирку. В обе пробирки одновременно было добавлено одинаковое количество (20 капель) концентрированной соляной кислоты. Время для каждой пробирки было зафиксировано, когда мел полностью растворился.
Таблица 6. Зависимость времени реакции от величины раздела реагирующих веществ
| № пробирки | Состав системы | Время τ, с |
| 1 | Мел кусочком + HCl | 194 |
| 2 | Мел в порошке + HCl | 35 |
CaCo3+2HCl=CaCl2+CO2+H2O
Вывод: мел в порошке растворяется быстрее, т.к. площадь взаимодействия кислоты с веществом в этом случае больше.
Опыт 5. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (
