Файл: Лабораторная работа 7 Исследование скорости химических реакций и химического равновесия ст группы тх 2 2.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.03.2024
Просмотров: 21
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
III) и тиоцианатом аммония.
В четыре пробирки было налито равное количество капель (7) разбавленных растворов хлорида железа (III) и тиоцианата аммония. Первая пробирка выступала в качестве эталона; во вторую пробирку прилили несколько капель концентрированного раствора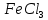 ; в третью пробирку дабавлено несколько капель концентрированного раствора
; в третью пробирку дабавлено несколько капель концентрированного раствора 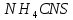 ; в четвёртую пробирку добавлен
; в четвёртую пробирку добавлен 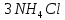 .
.
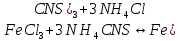
Признак реакции: изменение окраски раствора на красную.
Таблица 7. Зависимость положения равновесия от состава системы
При добавлении к реакционной системе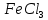 и
и 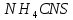 равновесие смещается вправо, при этом
равновесие смещается вправо, при этом 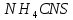 больше смещает равновесие в сторону образования продуктов реакции, так как коэффициент при
больше смещает равновесие в сторону образования продуктов реакции, так как коэффициент при 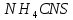 - тройка, а значит в уравнении константы химического равновесия концентрация
- тройка, а значит в уравнении константы химического равновесия концентрация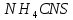 возведена в третью степень.
возведена в третью степень.
При добавлении к реакционной системе равновесие реакции смещается влево.
равновесие реакции смещается влево.
Вывод: Концентрация реагирующих веществ влияет на химическое равновесие так, что при увеличении концентрации реагентов равновесие смещается вправо, при увеличении концентрации продуктов – влево.
Вывод:
В данной лабораторной работе мы научились экспериментально определять скорость химической реакции и оценивать влияние различных факторов на характер их протекания и выяснили, что с повышением температуры увеличивается скорость химической реакции; с повышением концентрации реагирующих веществ скорость химической реакции возрастает. Также выяснили, что величина поверхности раздела реагирующих веществ влияет на скорость реакции, чем она больше, тем быстрее протекает реакция. Мы познакомились с понятием химического равновесия и на практике увидели его смещение в зависимости от добавляемых реагентов к реакционной системе.7
Санкт-Петербург
2022
В четыре пробирки было налито равное количество капель (7) разбавленных растворов хлорида железа (III) и тиоцианата аммония. Первая пробирка выступала в качестве эталона; во вторую пробирку прилили несколько капель концентрированного раствора
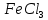 ; в третью пробирку дабавлено несколько капель концентрированного раствора
; в третью пробирку дабавлено несколько капель концентрированного раствора 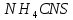 ; в четвёртую пробирку добавлен
; в четвёртую пробирку добавлен 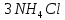 .
.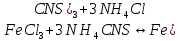
Признак реакции: изменение окраски раствора на красную.
Таблица 7. Зависимость положения равновесия от состава системы
| № пробирки | Состав системы | Добавленный реактив | Наблюдения |
| 1 | 7 капель разбавленного 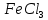 7 капель разбавленного 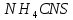 | Нет | Образование красного раствора |
| 2 | 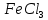 | Цвет раствора стал ярче, насыщеннее | |
| 3 | 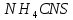 | Раствор окрасился в тёмно-кровавый цвет | |
| 4 | 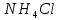 | Раствор стал светлее |
При добавлении к реакционной системе
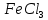 и
и 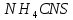 равновесие смещается вправо, при этом
равновесие смещается вправо, при этом 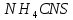 больше смещает равновесие в сторону образования продуктов реакции, так как коэффициент при
больше смещает равновесие в сторону образования продуктов реакции, так как коэффициент при 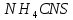 - тройка, а значит в уравнении константы химического равновесия концентрация
- тройка, а значит в уравнении константы химического равновесия концентрация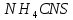 возведена в третью степень.
возведена в третью степень.
При добавлении к реакционной системе
 равновесие реакции смещается влево.
равновесие реакции смещается влево.Вывод: Концентрация реагирующих веществ влияет на химическое равновесие так, что при увеличении концентрации реагентов равновесие смещается вправо, при увеличении концентрации продуктов – влево.
Вывод:
В данной лабораторной работе мы научились экспериментально определять скорость химической реакции и оценивать влияние различных факторов на характер их протекания и выяснили, что с повышением температуры увеличивается скорость химической реакции; с повышением концентрации реагирующих веществ скорость химической реакции возрастает. Также выяснили, что величина поверхности раздела реагирующих веществ влияет на скорость реакции, чем она больше, тем быстрее протекает реакция. Мы познакомились с понятием химического равновесия и на практике увидели его смещение в зависимости от добавляемых реагентов к реакционной системе.7
Санкт-Петербург
2022
