Файл: Лабораторная работа 1 по предмету Химия Тема Гальванический элемент и Электролиз Выполнил работу Ст гр. Б22 8311зу Халезов С. В. Проверил К. т н., доцент.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.03.2024
Просмотров: 12
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования
«Ижевский государственный технический уневерситет имени М.Т. Калашникова»
Кафедра «Химия и химическая технология»
Лабораторная работа № 1
по предмету «Химия»
Тема «Гальванический элемент и Электролиз»
Выполнил работу:
Ст. гр. Б-22 831-1зу
Халезов С.В.
Проверил:
К.т.н., доцент
Семакина Н.В.
Ижевск
2023
Лабораторная работа №1
«Химический источник тока»
Цель работы:
Познакомиться с устройством и принципом работы гальванического элемента.
Теоретическая часть
-
Химические источники тока называются электрохимические устройства, в результате работы которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию постоянного тока. -
Возникновение двойного электрического слоя на границе металл-электролит
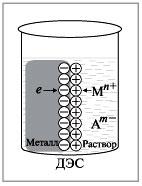
-
Для расчета таких равновесных потенциалов применяют формулу, предложенную в 1888 году немецким физикохимиком В. Нернстом. В общем виде формула выглядит так:
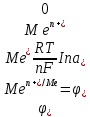
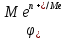 – электродный потенциал металла Me в растворе, содержащем катионы
– электродный потенциал металла Me в растворе, содержащем катионы 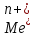 , вольт
, вольт 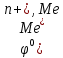 – стандартный электродный потенциал, вольт
– стандартный электродный потенциал, вольтR – универсальная газовая постоянная, Дж\моль.К
T – абсолютная температура, К
n – число электронов, участвующих в электродном процессе,
F – постоянная Фарадея, 96500 Кл/моль
a – активность ионов металла в растворе
-
Анод – электрод на котором наблюдается окислительная реакция, то есть он отдаёт электроны. Электрод, на котором происходит окислительная реакция – называется восстановителем.
Катод – электрод на котором протекает восстановительная реакция, то есть он принимает электроны. Электрод, на котором происходит восстановительная реакция – называется окислителем.
-
Э Д С гальванического элемента показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую.
«Экспериментальная часть»
Опыт №1
Составления медно-цинкового гальванического элемента.
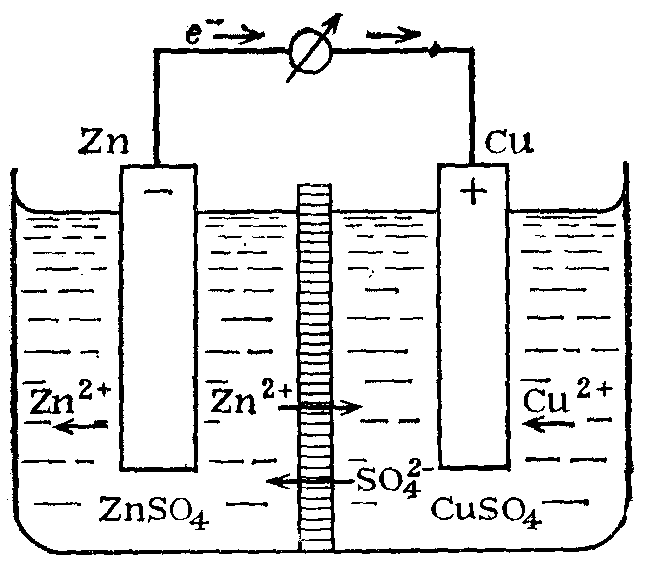
Рис: 1
1 − растворы
Решение:
-
Выпишем из таблицы :
: 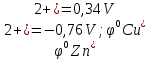
-
Из уравнения Нернста вычислим потенциалы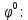
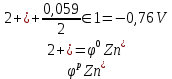
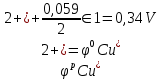
-
Находим анод и катод: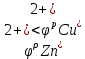
анод катод
-
Расчёт электродвижущие сила.
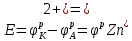 0,34-(-0,76) = 1,1 V
0,34-(-0,76) = 1,1 VE=1,1
-
Процесс окислительно-восстановительно реакция:
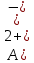 окисления
окисления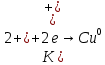 восстановления
восстановления-
Уравнение токообразующий реакции:
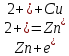
-
Медно-цинкового гальванического элемента:
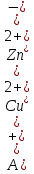
Вывод: Ознакомились устройством и принципом работы гальваническим элементом, провели расчёты.
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования
«Ижевский государственный технический университет имени М.Т. Калашникова»
Кафедра «Химия и химическая технология»
Лабораторная работа № 2
по предмету «Химия»
Тема «Гальванический элемент и Электролиз»
Выполнил работу:
Ст. гр. Б-22 831-1зу
Халезов С.В.
Проверил:
К.т.н., доцент
Семакина Н.В.
Ижевск
2023
Лабораторная работа №2
«Электролиз»
 Цель работы:
Цель работы: 1)Провести электролиз водных растворов солей с инертным и активным анодами, записать схемы электролиза.
Теоретическая часть.
-
Электролиз называют окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. Этот процесс сопровождается превращением электрической энергии в химическую. -
Напряжение разложения электролита это минимальное напряжение между электродами, при которой начинается электролиза. -
Закон Фарадея для электролиза
Первый закон Фарадея: массы вещества, осаждённого на электроде при электролизе, прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита.
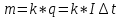
m-масса,
I-сила тока,
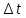 -промежуток времени,
-промежуток времени,k-коэффициент пропорциональности
Второй закон Фарадея: одинаковые количества электричества выделяют на электродах эквивалентные массы веществ.
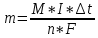
M-молярная масса вещества, г/моль;
I-сила тока, А;
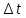 -промежуток времени которого проводит электролиз, сек;
-промежуток времени которого проводит электролиз, сек;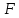 -постоянная Фарадея, Кл/моль;
-постоянная Фарадея, Кл/моль;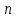 -число участвующих в процессе электронов.
-число участвующих в процессе электронов.«Экспериментальная часть»
Опыт №1. Электролиз водного раствора сульфата меди
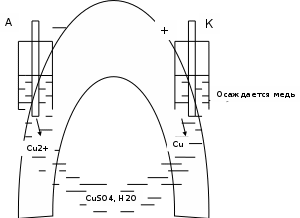
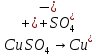
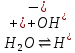
-K A+
A(+):
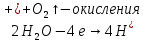
K(-):
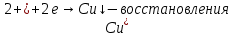
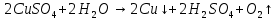
При включение питание электродов в сеть, на катоде образуется медь, а на аноде выделяется кислород. Когда меняем полярность местами, то медь уходит с катода и образуется на аноде.
Опыт №2. Электролиз водного раствора хлорида олова


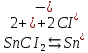
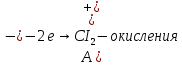
K(-):
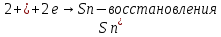
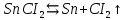
При включения питания электродов в сеть, на аноде выделяется хлор (окисления), а на катоде выделяются белые кристаллы олова. В качественной реакции
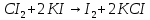 йод с крахмалом дает синее окрашивание.
йод с крахмалом дает синее окрашивание. 
Вывод: В ходе выполнении лабораторной работы провели опыты с электролизом водных растворов солей с инертными и активными анодами, составили схему электролиза.
22) Al/Al2(SO4)3 // Au2(SO4)3/Au
CAl3+ = 10-4M; CAu3+=2M
UPAl/Al3+=U0Al/Al3++
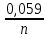 lg CAl3+= -1,662 B +
lg CAl3+= -1,662 B +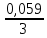 *lg*10-4=-1,741B
*lg*10-4=-1,741BUPAu/Au3+ +
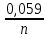 * lg CAu3+= +1,498B +
* lg CAu3+= +1,498B +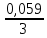 *lg2=1,504B
*lg2=1,504BАнод-Al ;Катод-Au
-На аноде: процесс окисления
Al0-3е-+nH2O[Al(H2O)n]3+
+На катоде: процесс восстановления
[Au(H2O)m]3+Au3++mH
2O+3e-Au0↓
Al- Al/Al2(SO4)3 // Au2(SO4)3 / Au +K
ЭДС=4K – 4A=1,504B-(-1,741)=3,245B
22) 0,001Mpp HCl ph=3 Катод-Sn
Анод-Cu
HCl →H+ + Cl-
H2O ↔ H+ +OH-
k- A+
На Аноде: 1)2Cl- -2e-→Cl2 0↑(окисление)
2)2H2O – 4e-→O20↑+4H+(окисление)
1)Up2Cl-/Cl20= U02Cl-/Cl20+
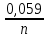 * lg CCl- = +1,358 +
* lg CCl- = +1,358 + 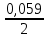 * lg 0,001=1,2695B
* lg 0,001=1,2695B2) UpH20-/o2=1,23-0,059pH+nAO2=1.23-0,059+1,05=2,103B
На аноде идет процесс окисление
Хлорад ионов из ра-р (при анодной среде чуть закисляется)
На катоде (-): 1)2H+ +2e- → H2↑(Восстановление)
2)2H2o + 2e- → H20↑ +2OH- (Восстановление)
1) Up2H+/H20= -0,059*pH=-0,177B
2) UpH20-/H20= -0,059pH-nKH2=-0,059*3-0,82=-0,997B
На катоде идет процесс восстановления водорода из р-ра HCl; при катодное пр-во защелачивается.
2HCL →+HOH Cl20+H20
