ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.03.2024
Просмотров: 29
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Лабораторная работа №12
| По дисциплине | ФИЗИКА |
| (наименование учебной дисциплины согласно учебному плану) | |
| Тема: Исследование эффекта Джоуля-Томпсона при адиабатическом истечении газа. |
Вариант №6
| Автор: студент гр. ЭРБ-18-1 | | ________________ | /_Сковородкин И.И.._/ | |
| | | (подпись) | | |
| ОЦЕНКА: ___________ | | | | |
| Дата: ________________ | | | | |
| ПРОВЕРИЛ | ассистент | ______________ | /Скалецкая И.Е. / | |
| | (должность) | (подпись) | (Ф.И.О.) | |
Санкт-Петербург
2018 год
Цель работы:
-
определение изменения температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; -
вычисление по результатам опытов коэффициентов Ван-дер-Ваальса "a" и "b"
Краткое теоретическое содержание:
Явление, лежащее в основе работы: эффект Джоуля-Томсона.
Определение основных физических понятий, объектов, процессов и величин:
Эффект Джоуля-Томсона - изменение температуры газа, медленно протекающего из области высокого в область низкого давления в условиях хорошей тепловой изоляции.
Адиабатический процесс - термодинамический процесс, который осуществляется в системе без теплообмена с внешним миром.
Идеальный газ – теоретическая модель газа, в которой между молекулами отсутствуют силы взаимного притяжения и сами молекулы принимаются за материальные точки.
Тепловое расширение - изменение размеров тела в процессе его нагревания.
Температура инверсии - повышение температуры воздуха с высотой в некотором слое атмосферы.
Критическая температура - температура, при которой исчезают различия физических свойствах между жидкостью и ее насыщенным паром.
a и b – константы Ван-дер-Ваальса, которые являются характеристикой каждого газа
Законы и соотношения, описывающие изучаемые процессы, на основании которых получены расчётные формулы:
Первый закон термодинамики– теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил. Q=∆U+A, где Q – количество теплоты, Дж; U – внутренняя энергия, Дж; A – работы, Дж
Уравнение Менделеева-Клапейрона (идеального газа) – формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа, имеющая вид:
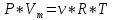
где P – давление [Па] V – объём [м^3] R – универсальная газовая постоянная,
R=8,31 [Дж/(моль∙К)] T – температура, [К]
Уравнение Ван-дер-Ваальса (реального газа) – формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой реального газа при помощи коэффициентов Ван-дер-Ваальса, имеющая вид:
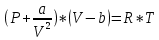
Поправка a (
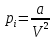 ) – поправка, учитывающая силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь).
) – поправка, учитывающая силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь).
Поправка b — поправка, учитывающая силы отталкивания (из общего объёма вычитается объём, занимаемый молекулами).
Схема установки:
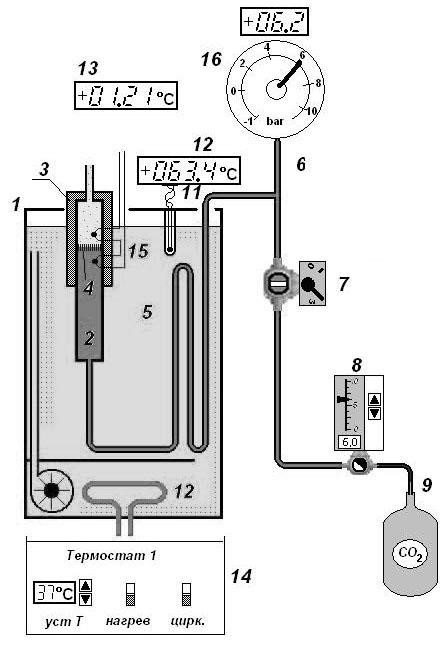
-
теплоизоляционная защит -
каналы пористой перегородки -
трубка с пористой перегородкой -
пористая перегородка -
теплообменник -
магистраль -
кран -
редуктор -
балон с газом -
индикатор температуры воды -
термопара -
термостат -
индикатор, отображающий дифференциальную температуру -
пульт -
дифференциальный термометр -
манометр
Расчётные формулы:
1.Перепад давлений в теплоизолированной трубке:
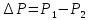 , где
, где 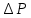 - разность давлений, [
- разность давлений, [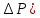 =Па,
=Па, 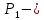 начальное давление,
начальное давление, 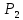 - атмосферное давление
- атмосферное давление2.Коэффициент Джоуля-Томсона:
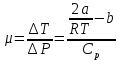 где –
где – 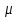 коэффициент Джоуля –Томсона [C/Па]
коэффициент Джоуля –Томсона [C/Па]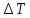 - Разность температур [C]
- Разность температур [C]a - постоянная Ван-дер-Ваальс [
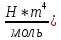
R - универсальная газовая постоянная [Дж/(моль*К)]
b- постоянная Ван-дер-Ваальса [(м^3)/моль]
3.Температура инверсии:
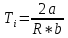
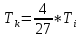
Экспериментальные данные
| Физ.величина |  | 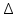 P P | 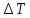 | µ | a | b | Tинв | Tкр |
| Ед. изм. | | | | | | | | |
| Номер опыта | ||||||||
| 1 | 20 | 9,0 | 9,87 | 1,097 | 0.356 | 35,203 | | |
| 2 | 8,0 | 8,74 | 1,093 | |||||
| 3 | 7,5 | 8,18 | 1,091 | |||||
| 4 | 6,5 | 7,07 | 1,088 | |||||
| 5 | 5 | 5,41 | 1,082 | |||||
| 6 | 40 | 9,0 | 8,80 | 0,978 | ||||
| 7 | 8,0 | 7,81 | 0,976 | |||||
| 8 | 7,5 | 7,31 | 0,975 | |||||
| 9 | 6,5 | 6,32 | 0,972 | |||||
| 10 | 5,0 | 4,85 | 0,970 | |||||
| 11 | 75 | 9,0 | 7,49 | 0,832 | ||||
| 12 | 8,5 | 7,07 | 0,832 | |||||
| 13 | 8,0 | 6,65 | 0,831 | |||||
| 14 | 7,5 | 6,24 | 0,832 | |||||
| 15 | 6,5 | 5,40 | 0,831 | |||||
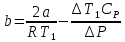
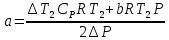
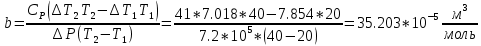
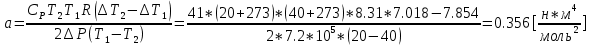
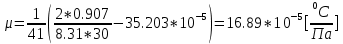
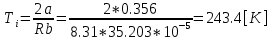
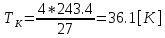
Погрешности
Прямые
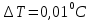 ;
; 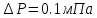
Косвенные
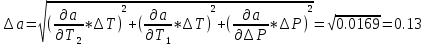
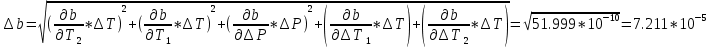
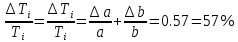
Вывод
В ходе проведенной лабораторной работы было определено изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; по результатам опытов определены коэффициенты Ван-дер-Ваальса.
