Файл: Отчет по лабораторной работе 1 По дисциплине Химия (наименование учебной дисциплины, согласно учебному плану).docx
Добавлен: 18.03.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования Российской Федерации

Федеральное государственное бюджетное образовательное учреждение высшего образования
Санкт-Петербургский горный университет
Кафедра общей химии
Отчет по лабораторной работе №1
По дисциплине: Химия
(наименование учебной дисциплины, согласно учебному плану)
Тема работы: исследование реакций в растворах электролитов
Выполнил: студент гр.
(шифр группы) (подпись) (Ф.И.О)
Оценка:
Дата:
Проверил
руководитель работы: доцент Згонник П.В.
(должность) (подпись) (Ф.И.О)
Санкт-Петербург
2022
Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять уравнения.
Общие сведения
Электролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.
Количественно способность электролита распадаться на ионы характеризуется степенью диссоциации
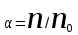
где n – число продиссоциированных молей, n
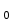 - исходное число молей электролита.
- исходное число молей электролита.Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению
АВ
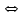 А
А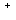 + В
+ В
При постоянной температуре произведение концентраций конечных и исходных веществ постоянно и называется константой диссоциации
К
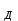 =
= 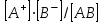
где множители – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг.
По степени и величине константы диссоциации все электролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе диссоциируют практически полностью, слабые – частично. Закон действующих масс справедлив лишь для слабых электролитов.
К сильным относятся:
-
Кислоты: азотную HNO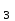 , серную H
, серную H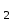 SO
SO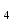 ,соляную HCL, бромисто и йодистоводородную HBr и HJ,хлорную HCLO
,соляную HCL, бромисто и йодистоводородную HBr и HJ,хлорную HCLO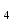 .
. -
Гидроксиды щелочных металлов, стронция и бария. -
Растворимые соли.
Остальные электролиты являются слабыми. Малодиссоциированными соединениями являются также комплексные ионы в растворе. Константы их диссоциации даны в справочниках.
Правила написания молекулярно-ионных уравнений реакций в растворах электролитов:
1. Сильные и хорошо растворимые электролиты записывают в диссоциированной форме, виде отдельных составляющих ионов.
-
Слабые электролиты, сложные ионы, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной, недиссоциированной форме. -
Одинаковые ионы в левой и правой частях уравнения сокращают, подобно алгебраическим уравнениям.
Отсюда вытекают условия протекания реакций в растворах электролитов:
-
Образование или растворение малорастворимого соединения, выпадающего в осадок. Растворимость соединений определяют по таблицам. -
Образование или разрушение малодисоциированного соединения, иона или комплекса. -
Выделение или растворения газа.
Порядок выполнения работы:
Опыт 1
FeCl
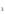
+ KOH
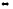 Fe (OH) 3
Fe (OH) 3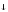 + 3KCl
+ 3KClFe3+ + 3OH -
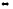 Fe (OH) 3
Fe (OH) 3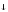
(появление бурого осадка)
CuSO4 + 2KOH
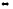 Cu (OH) 2
Cu (OH) 2 + K2SO4
+ K2SO4Cu2+ + 2OH -
 Cu (OH) 2
Cu (OH) 2
(появился ярко-голубой осадок)
NiSO4 + 2KOH
 Ni (OH) 2
Ni (OH) 2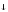 + K2SO4
+ K2SO4Ni2+ + 2OH -
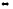 Ni (OH) 2
Ni (OH) 2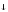
(выпал светло-зелёный осадок)
Ответы на вопросы:
К какому классу относятся полученные осадки гидроксидов металлов?
Полученные осадки гидроксидов металлов являются сильными основаниями.
Опыт 2.
2Fe (OH) 3
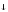 + 3HCl (р-р)
+ 3HCl (р-р) 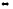 2FeCl
2FeCl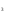 + 2H2O
+ 2H2OFe (OH) 3
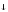 + 3H+
+ 3H+ 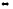 Fe3+ + 3H2O
Fe3+ + 3H2O(желтоватый раствор)
Cu (OH) 2
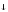 + 2HCl (р-р)
+ 2HCl (р-р) 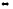 CuCl2 + 2 H2O
CuCl2 + 2 H2OCu (OH) 2
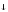 + 2H+
+ 2H+ 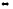 Сu2+ + 2 H2O
Сu2+ + 2 H2O(почти прозрачный, светло-голубой раствор)
Ni (OH) 2
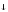 + 2HCl (р-р)
+ 2HCl (р-р) 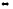 NiCl2 + 2H2O
NiCl2 + 2H2ONi (OH) 2
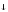 + 2H+
+ 2H+ 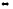
Ni2+ + 2H2O
(прозрачный раствор)
После добавления соляной кислоты все осадки распались.
Ответы на вопросы:
Какое новое малодиссоциированное соединение при этом образуется?
Образуется вода.
Опыт 3(А)
Pb (NO3) 2 + 2KI
 PbI2
PbI2  + 2KNO3
+ 2KNO3Pb2+ + 2J -
 PbI2
PbI2 
(выпал ярко-жёлтый осадок)
Pb (NO3) 2 +BaCl2
 PbCl2
PbCl2 + Ba (NO3) 2
+ Ba (NO3) 2Pb2+ + 2Cl -
 3PbCl2
3PbCl2
(выпал белый осадок)
Опыт 3(Б)
Na2SO4 + BaCl2
 2NaCl + BaSO4
2NaCl + BaSO4
SO42- + Ba2+
 BaSO4
BaSO4
(выпал густой белый осадок)
Cr2(SO4)3 + 3BaCl2
 2CrCl3 + 3BaSO4
2CrCl3 + 3BaSO4
3SO42- + 3Ba2+
 3BaSO4
3BaSO4
(выпал густой белый осадок)
Опыт 4.
ZnSO4 + 2 NaOH
 Zn (OH) 2
Zn (OH) 2 +3Na2SO4
+3Na2SO4Zn2+ + 2OH -
 Zn (OH) 2
Zn (OH) 2
(появился белый осадок)
Zn (OH) 2
 +2HCl
+2HCl  ZnCl2 +2H2O
ZnCl2 +2H2OZn (OH) 2
 +2H+
+2H+  Zn2+ 2H2
Zn2+ 2H2
O
(осадок растворился)
ZnSO4 + 2 NaOH
 Zn (OH) 2
Zn (OH) 2 +3Na2SO4
+3Na2SO4Zn (OH) 2
 + 2 NaOH (в избытке)
+ 2 NaOH (в избытке)  Na2 [Zn (OH) 4]
Na2 [Zn (OH) 4]Zn (OH) 2
 + 2OH -
+ 2OH -  [Zn (OH) 4] 2-
[Zn (OH) 4] 2-(выпал белый осадок)
Опыт 4(Б)
Al2(SO4)3 + 6 NaOH
 2Al(OH) 3
2Al(OH) 3 +3Na2SO4
+3Na2SO42Al3+ + 6OH1-
 2Al(OH) 3
2Al(OH) 3
(выпал белый осадок)
Al(OH)3
 +3HCl
+3HCl  AlCl3 +3H2O
AlCl3 +3H2OAl(OH) 3
 +3H+
+3H+  Al3+ + 3H2O
Al3+ + 3H2O(Осадок растворился)
Al(OH)3
 + NaOH (в избытке)
+ NaOH (в избытке)  Na[Al(OH) 4]
Na[Al(OH) 4]Al(OH)3
 + OH -
+ OH -  [Al(OH)4] -
[Al(OH)4] -(Осадок растворился)
Опыт 4(В)
Cr2(SO4)3 + 6NaOH
 2Cr(OH)3
2Cr(OH)3 + 3Na2SO4
+ 3Na2SO42Cr3+ + 6OH-
 2Cr(OH)3
2Cr(OH)3
(Выпал зеленый осадок)
Cr(OH)3 + 3HCl
 CrCl3
CrCl3 + 3H2O
+ 3H2OCr3+ + 3Cl-
 CrCl3
CrCl3
Cr(OH)3 + NaOH
 Na[Cr(OH)3]
Na[Cr(OH)3]