ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 18
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ДИФТЕРИИ
Возбудитель Corynebacterium diphtheriae входит в семейство Corynebacteriaсае, род Corynebacterium. Материалом для исследования служит пленка с миндалин, слизь из зева и носа, отделяемое пораженных участков кожи и слизистых.

Corynebacterium diphtheriae
Отбирают материал двумя стерильными ватными квачами и немедленно, не позднее чем через 3 часа, доставляют в лабораторию.
Микробиологическую диагностику дифтерии проводят тремя методами: микроскопическим, бактериологическим, серологическим.
Микроскопический метод. Из исследуемого материала, взятого одним квачом, готовят 2 мазка и окрашивают их по Граму и Нейссеру. При окраске по Нейссеру в мазках обнаруживаются микробы палочковидной формы, располагающиеся в виде римской пятерки (V). Палочки имеют соломенно-желтый, а зерна волютина (Бабеша-Эрнста) на концах - темно-синий цвет. Этот способ окрашивания позволяет отличить Corynebacterium diphtheriae от Corynebacterium pseudodiphtheriticum, у которых не обнаруживаются зерна Бабеша-Эрнста. Эти результаты микроскопического исследования рассматриваются как ориентировочные, так как в препарате могут быть и другие зернистые микробные клетки.
При окраске по Граму зерна волютина не проявляются, но грамположительная окраска и характер расположения дифтерийных палочек позволяет косвенно отличить их от непатогенных коринебактерий, располагающихся параллельно друг другу.
Бактериологический метод.
Является основным методом диагностики дифтерии. Он включает выделение чистой культуры микробов, идентификацию их, обязательную проверку способности выделенной культуры коринебактерий вырабатывать экзотоксин.
Исследуемый материал, взятый квачом тампоном, высевают на кровяной теллуритовый агар в чашках Петри и помещают в термостат. В зависимости от биовара на кровяном теллуритовом агаре могут вырасти большие колонии серовато-черного цвета, плоские, шероховатые, радиально исчерченные, с зубчатыми краями (gravis), мелкие выпуклые, блестящие и черные колонии с гладкой поверхностью и ровными краями (mitis), мелкие плоские колонии с более темным центром, иногда с неровными краями (intermedius).
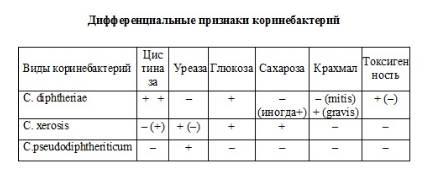
Для получения чистой культуры микробов часть подозрительной колонии пересевают на скошенную свернутую сыворотку (среда РУ, Леффлера). После инкубации в термостате на этих средах наблюдается рост дифтерийной палочки в виде «шагреневой кожи» (колонии микроорганизмов сливаются, но центр их остается возвышенным). Определив под микроскопом чистоту выделенной культуры, идентифицируют микроорганизмы путем изучения биохимических свойств. Для этого их засевают в среды Гисса (глюкоза, лактоза, маннит, мальтоза, сахароза), в среду с крахмалом, гликогеном.
Для выявления цистиназы делают посев в специальную среду с цистином и уксуснокислым свинцом. Отмечают почернение среды по ходу посева.
Для определения способности микроба расщеплять мочевину делают посев в бульон с 1% мочевины и индикатором крезолротом. Покраснение среды не отмечают, так как возбудители дифтерии не имеют уреазной активности.
Токсигенность дифтерийной палочки можно обнаружить как in vivo, так и in vitro.
In vivo. Морским свинкам внутрикожно вводят фильтрат бульонной культуры дифтерийных бактерий. Если микробы вырабатывают экзотоксин, то в месте введения культуры образуется некроз ткани.
Наибольшее распространение получили опыты in vitro. При этом используют реакцию преципитации в геле. На поверхность питательной среды в центре чашки Петри размещают полоску фильтровальной бумаги, пропитанной антитоксической противодифтерийной сывороткой. Культуры исследуемых микробов высевают бляшками с обеих сторон полоски. Контролем является известный токсигенный штамм дифтерийной палочки. Чашки с посевами инкубируют при t 37°С, результаты учитывают через 24-48 часов. Если дифтерийные палочки продуцируют экзотоксин, то он, диффундируя в агар и встречаясь с антитоксином, образует четкую линию преципитата, которая сливается с линией преципитата токсигенного (контрольного) штамма.
Изучение вышеперечисленных свойств выделенной культуры позволяет отличить дифтерийную палочку от других коринебактерий (дифтероидов и псевдодифтерийных).
Серологический метод
Является вспомогательным. Применяют реакцию агглютинации. Сыворотки больных разводят 3% раствором натрия хлорида в соотношении 1: 100, 1: 200, 1: 400, 1: 800, 1: 1 600. К разведениям сыворотки добавляют специально приготовленный диагностикум (дифтерийная культура, смытая 3% раствором натрия хлорида и убитая 0,2% раствором формалина). Реакцию считают положительной при разведении сыворотки не менее 1:100. Используется также реакция пассивной гемагглютинации с эритроцитарным бактериальным диагностикумом. Диагностическим считают титр 1: 8 и выше, если он регистрируется на второй неделе от начала болезни.
