Файл: Отчет по лабораторной работе 2 По дисциплине общая химия наименование.docx
Добавлен: 27.03.2024
Просмотров: 36
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей и физической химии
Отчет по лабораторной работе №2
По дисциплине ОБЩАЯ ХИМИЯ
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование реакции в растворах электролитов
Автор: студент группы ИЗБ-22-1 / Сень С. С. /
(шифр группы) (подпись) (Ф.И.О.)
ОЦЕНКА:
Дата: 2022 г.
ПРОВЕРИЛ / /
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2022 г.
Исследование реакции в растворах электролитов
Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения.
Выполнение работы
1)
Опыт 1. Образование малорастворимых оснований. В одну пробирку налить 3−5 капель раствора соли железа (III), в другую – столько же раствора соли меди (II), в третью – раствора соли никеля (II). В каждую пробирку добавить по несколько капель раствора щелочи до выпадения осадков. Осадки сохранить до следующего опыта.
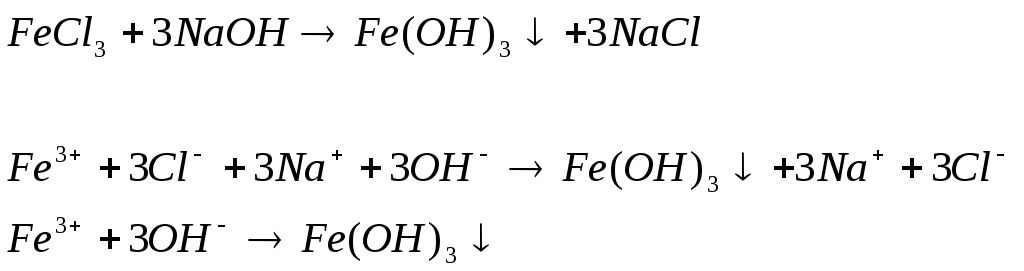
Наблюдаем осадок оранжевого цвета
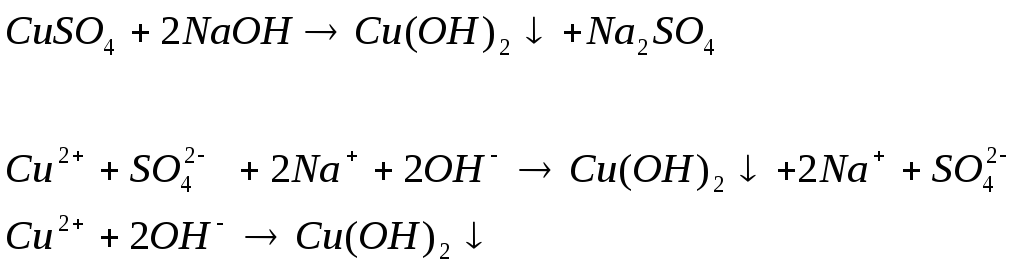
2)
Н
3)
аблюдаем осадок синего цвета
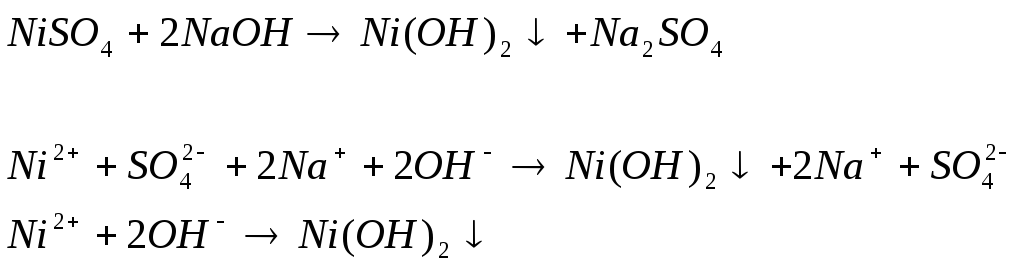
Наблюдаем осадок зеленого цвета
Ответ: Не являются, так как они малорастворимые
О
1)
пыт 2. Растворение малорастворимых оснований. К полученным в предыдущем опыте осадкам добавить по несколько капель раствора соляной кислоты концентрацией 15 % до их полного растворения.
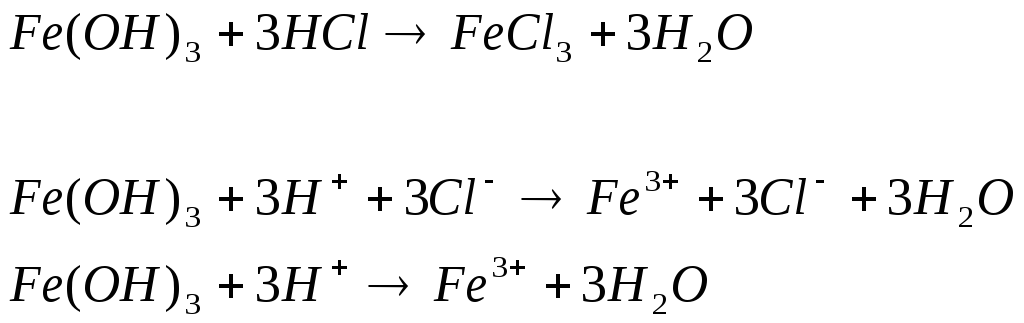 Наблюдаем растворение осадка и образование исходного вещества и воды
Наблюдаем растворение осадка и образование исходного вещества и воды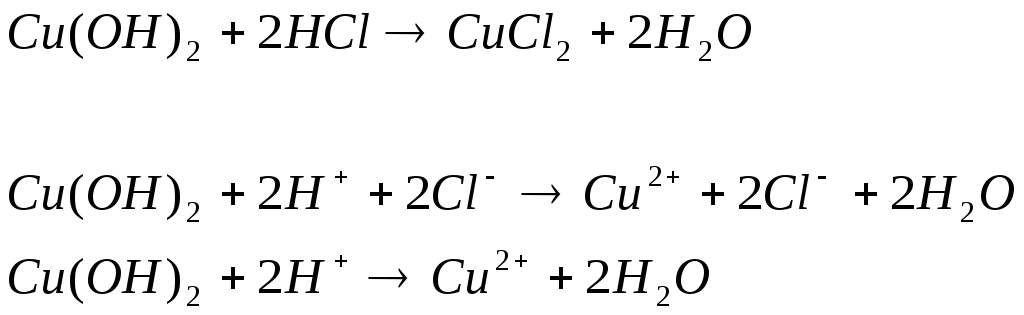
2)
3)
Наблюдаем растворение осадка и образование воды
 Наблюдаем растворение осадка и образование воды
Наблюдаем растворение осадка и образование водыВывод: образуется вода.
Опыт 3. Образование малорастворимых солей
А. В две пробирки налить по 3−5 капель раствора нитрата свинца (II) и прибавить в одну пробирку несколько капель йодида калия, в другую – хлорида бария.
1)
Образуется желтый осадок
2) Рb(NO3)2 +BaCl2
Выпадает осадок белого цвета
Pb2+ + 2NO3- + Ba2+ + 2Cl-
Ba2+ + 2NO3-
Б. В одну пробирку налить 3−5 капель раствора сульфата натрия
, в другую – столько же раствора сульфата хрома (III). В каждую пробирку добавить несколько капель раствора хлорида бария до выпадения осадков.
1) Na2SO4 + BaCl2 = 2NaCl + BaSO4
Выпадает осадок белого цвета
2Na+ + SO42- +Ba2+ +Cl- = 2Na+ + 2Cl- + BaSO4
SO42- +
2) Cr2(SO4)3 + 3BaCl2 = 2CrCl3 + 3BaSO4
Образуется сульфат бария. Аналогичная реакция будет протекать
Опыт 4.
А. В две пробирки внести по 3 капли раствора соли цинка и несколько капель разбавленного раствора едкого натра (из штатива с реактивами) до образования осадка гидроксида цинка. Растворить полученные осадки: в одной пробирке – в растворе соляной кислоты, в другой – в избытке концентрированного раствора едкого натра (из вытяжного шкафа).
1)
Наблюдаем выпадение осадка белого цвета
2)
Наблюдаем растворение осадка и получение исходного вещества
