Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 131
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
электролита и ионами электролита в растворе, например:
BaSO4 (тв.) ⇄Ba2+ (р-р) + SO42– (р-р)
Т.к. в растворах электролитов состояние ионов определяется их активностями, то константа равновесия процесса выразится уравнением

Активность сульфата бария является при данной температуре константой. Следовательно, произведение активностей ионов Ba2+ и SO42– представляют собой постоянную величину, называемую произведением растворимости и обозначаемую ПР:

Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициент активности ионов мало отличается от единицы. В подобных случаях произведение активностей ионов в выражении можно заменить произведением их концентраций
 ,
, 
41.Ряд напряжений металлов.Электродные потенциалы
Электролиз. Законы Фарадея. Функции катода и анода при электролизе, факторы
влияющие на характер окислительно-восстановительного процесса в электролизере (активные, инертные электроды). Электролиз из расплава на активных электродах, электролиз из расплава на инертных электродах, электролиз соли из растворов.
Электродный потенциал. Гальванический элемент.
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
При погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют
электродным потенциалом.
Электродный потенциал металла опущенного в раствор собственной соли, связан с ним уравнением Нернста.
φ = φ0+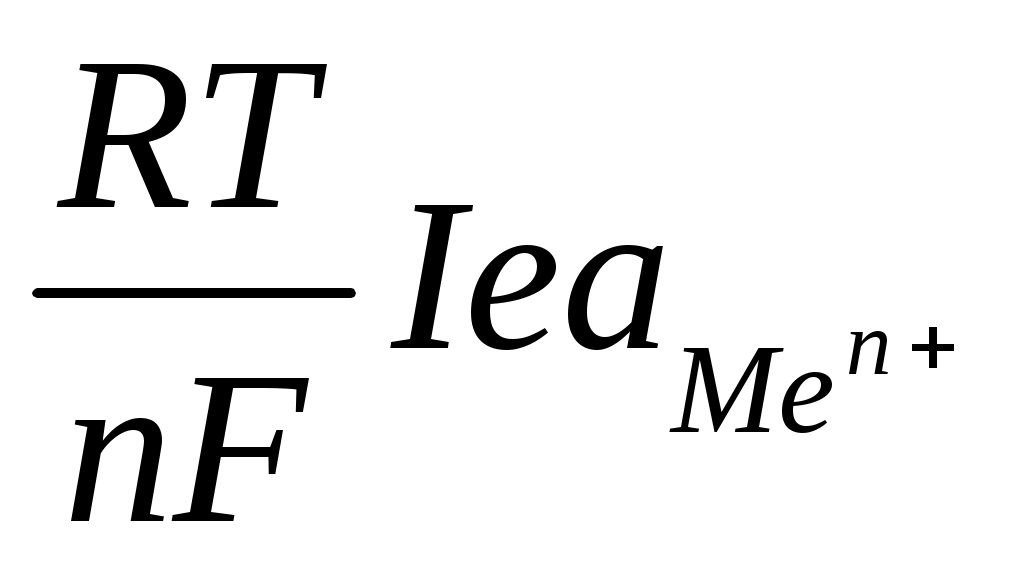
где φ – электродный потенциал металла
φ0- стандартный электродный потенциал металла, определяемый при условии, что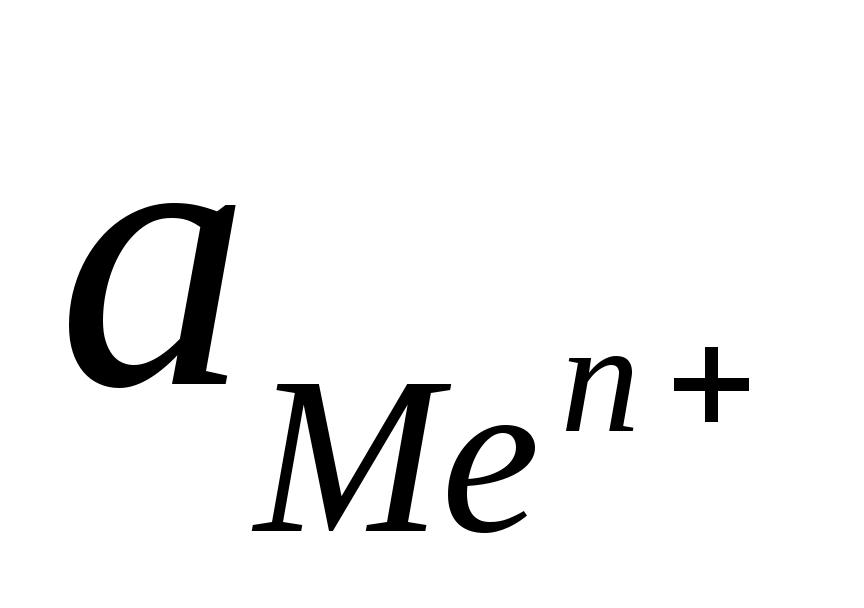 =1
=1
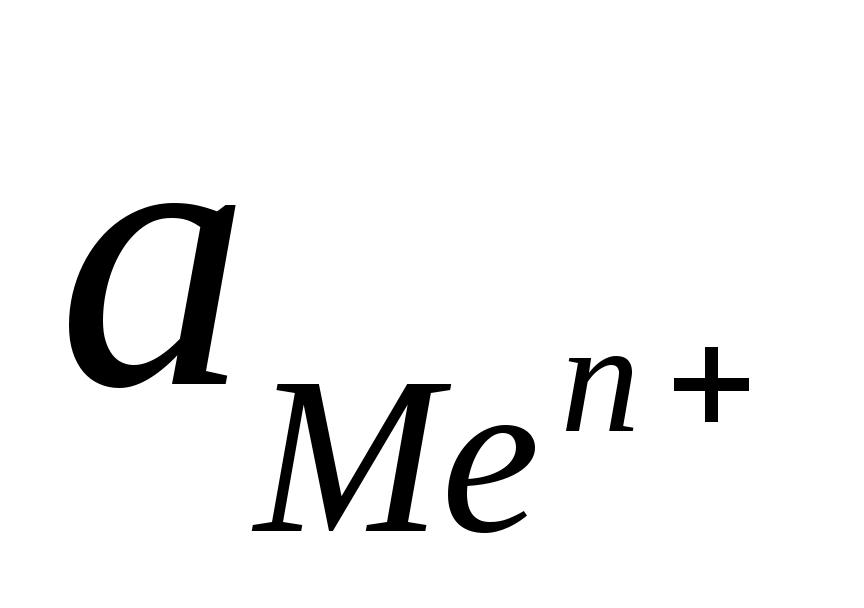 - активность ионов металла, где + зависит от сил взаимодействия ионов в растворе. а =f с
- активность ионов металла, где + зависит от сил взаимодействия ионов в растворе. а =f с
f- коэффициент активности, зависящий от сил взаимодействия ионов в растворе.
R – универсальная газовая постоянная 8,314 дж/к моль
T- температура раствора
N – число электронов, сопровождающее окислительно-восстановительный процесс на электроде.
F- количество электричества, переносимое единицей заряда за единицу времени через единицу поверхности электрода ( постоянная Фарадея равная 96 485 кул/моль при стандартных условиях Р= 101,325 кПа, Т= 298 К (250С).
Абсолютное значение потенциала одного отдельно взятого электрода измерить нельзя. Определить числовое значение (φ) электродного потенциала можно только путем измерения разности потенциалов между изучаемым электродом и другим потенциалом, которого известен.
В соответствии с международным соглашением электродные потенциалы отсчитывают относительно потенциала стандартного водородного электрода принятого равным (0) нулю.
(Е) ЭДС гальванического элемента определяется как разность потенциалов его электродов Е =φ2-φ1 Это величина всегда должна быть положительной т.е. φ2>φ1 . В противном случае изменение энергии Гиббса системы (∆G)(изобарного потенциала системы) связанного с Е (ЭДС) обратной зависимостью ∆G=-nFЕ станет больше нуля, а это означает, что если ∆G>0 такой процесс термодинамически невероятен для закрытых и открытых систем.
Следовательно, в любом гальваническом элементе: а для разбавленных растворов, когда, а=с Ео/в=Е0о/в+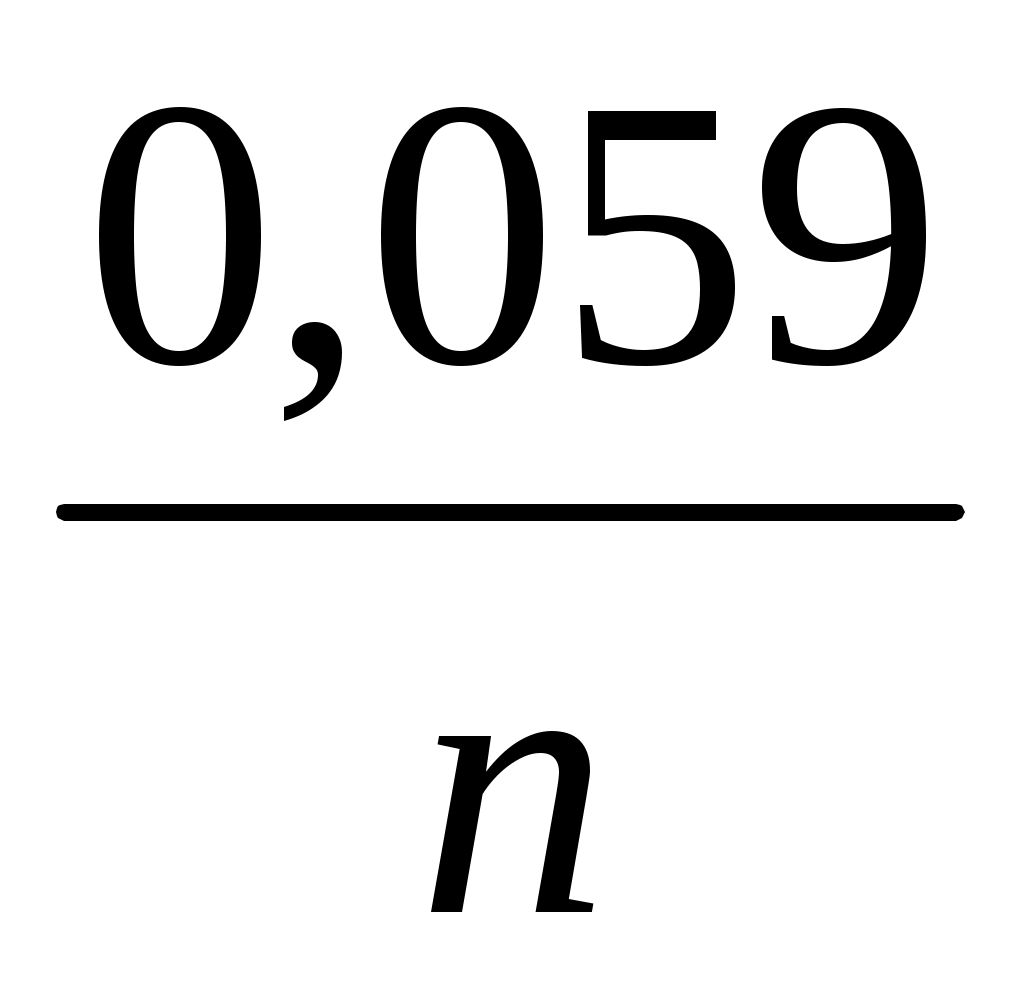 lq
lq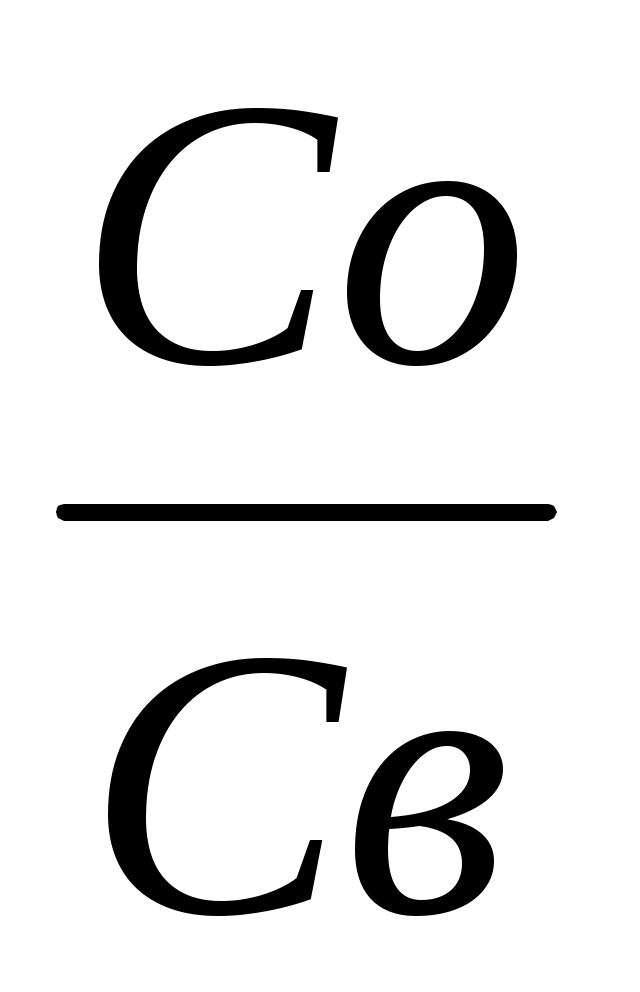
Е =φок –φвосст.
=Е0+ где Е0= φ0ок –φ0восст
где Е0= φ0ок –φ0восст
∆G =-RTInK где К константа обратимого окислительно –восстановительного процесса.
Стандартные электродные потенциалы металлов, расположенные в порядке возрастания их числовых значений называются рядом напряжений металлов:
Li; K;Сa,Na,Mg,Aℓ,Mn,Zn,Fe,Co,Ni,Sn,H2, Cu, Ag, Au,Pt.
Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак «-«, а знаком «+» отмечены стандартные потенциалы электродов, являющихся окислителями.
Ряд напряжений характеризует химические свойства металлов:
1.Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3.Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Электролиз.
ОВР, протекающие на электродах при прохождении через электролит электрического тока – электролиз.
Для осуществления электролиза необходимы:
1) источник постоянного тока (стационарный электролиз);
2) электролит – водный раствор или расплав;
3) электроды.
Электрод, соединенный с отрицательным полюсом источника тока называется катод, на нем идет процесс восстановления (присоединения электронов), находящихся в растворе ионов металла или ионов водорода (как восстановление воды). Катод является лишь передатчиком электронов. Электрод, соединенный с положительным полюсом источника тока, называется анодом, на нем происходит процесс окисления (отдача электронов). Аноды бывают: растворимые и нерастворимые, инертные, они служат для отвода электронов.
Количественные законы электролиза были установлены Фарадеем.
Первый закон. Масса веществ, выделившихся при электролизе на электродах, пропорциональна количеству прошедшего через раствор электричества и не зависит от его концентрации и температуры
m = k×qили m = k×I×t
где m– масса металла, г; k– электрохимический эквивалент; I– сила тока, А;
t – время электролиза, с; q– количество электричества = I×t. Электрохимическим эквивалентом металла называется его масса, выделяющаяся на электроде при прохождении 1 кулон электричества, и характеризует природу металла.
Второй закон. Равные количества электричества выделяют при электролизе массы веществ, пропорциональные их химическим эквивалентам:
 , тогда объединенный закон:
, тогда объединенный закон: 
где М– молекулярная масса; n– валентность металла; хэ = М/n;
F– число Фарадея.
Из объединенного закона Фарадея следует, что nF– количество электричества, необходимое для выделения 1 моль атома металла или генерируемое гальваническим элементом при растворении такого же количества металла. Работа электрического тока (А), генерируемого в ХИТ при растворении 1 моль металла, равна А = nFE, где E = ЭДС ХИТ.
Электродные процессы при электролизе.
Катодные процессы.
для правильного написания окислительно-восстановительных процессов, протекающих на электродах, нужно руководствоваться следующими правилами:
1. Катионы металлов, находящиеся в электрохимическом ряду напряжений после водорода при электролизе практически полностью восстанавливаются на катоде:
Меn+ +nе = Ме0 Си2+ +2е →Си0
Если в растворе есть несколько катионов, то первым выделяется металл, стоящий в ряду напряжений правее всего.
2.Катионы металлов, находящиеся в ряду напряжений до алюминия, не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды по схеме: 2Н
2О + 2е = Н2 + 2ОН-
3.Катионы металлов, находящиеся в ряду напряжений между алюминием и водородом, при электролизе на катоде восстанавливаются одновременно с молекулами воды.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом.
Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза.
Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На инертном аноде при электролизе водных растворов6
А) содержащих анионы F-, SO42-, NO3-, PO43-, OH- выделяется кислород по схеме:
в щелочной среде : 4ОН— -4е=О2+2Н2О
в кислой, нейтральной среде: 2Н2О -4е = О2+ 4Н+
Б) при окислении галогенид-ионов выделяются свободные галогены;
В)при окислении анионов органических кислот происходит процесс:
2 RСОО- -2е = R –R+2СО2
4. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах.
При электролизе водных растворов бескислородных кислот и их солей (кроме НF) у анода разряжаются анионы
На инертном или нерастворимом, аноде (графит, платина) возможны два процесса:
а) Если ионы кислотного остатка не содержат атомов кислорода, то окисляются именно они, например:
2С1 -2е → С12
б) Если ионы кислотного остатка содержат атомы кислорода то окисляются ионы ОН-:
4ОН— -4е→О2 +2Н2О
2)Если анод растворимый (медь, никель), то происходит окисление материала анода, и металл переходит в раствор в виде ионов, например:
Ni -2е→ Ni2+.
Рассмотрим электролиз водного раствора NaCl, рН=7. Анод нерастворимый.
К.: 2H2O + 2 ®H2+2OH–
®H2+2OH–
А.: 2Cl– – 2 ®Cl2
®Cl2
При электролизе расплава NaCl (графитовые электроды) идет разложение
NaCl = Na+ + Cl–, под током:
К.: Na– +
BaSO4 (тв.) ⇄Ba2+ (р-р) + SO42– (р-р)
Т.к. в растворах электролитов состояние ионов определяется их активностями, то константа равновесия процесса выразится уравнением
Активность сульфата бария является при данной температуре константой. Следовательно, произведение активностей ионов Ba2+ и SO42– представляют собой постоянную величину, называемую произведением растворимости и обозначаемую ПР:
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициент активности ионов мало отличается от единицы. В подобных случаях произведение активностей ионов в выражении можно заменить произведением их концентраций
41.Ряд напряжений металлов.Электродные потенциалы
Электролиз. Законы Фарадея. Функции катода и анода при электролизе, факторы
влияющие на характер окислительно-восстановительного процесса в электролизере (активные, инертные электроды). Электролиз из расплава на активных электродах, электролиз из расплава на инертных электродах, электролиз соли из растворов.
Электродный потенциал. Гальванический элемент.
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
При погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют
электродным потенциалом.
Электродный потенциал металла опущенного в раствор собственной соли, связан с ним уравнением Нернста.
φ = φ0+
где φ – электродный потенциал металла
φ0- стандартный электродный потенциал металла, определяемый при условии, что
f- коэффициент активности, зависящий от сил взаимодействия ионов в растворе.
R – универсальная газовая постоянная 8,314 дж/к моль
T- температура раствора
N – число электронов, сопровождающее окислительно-восстановительный процесс на электроде.
F- количество электричества, переносимое единицей заряда за единицу времени через единицу поверхности электрода ( постоянная Фарадея равная 96 485 кул/моль при стандартных условиях Р= 101,325 кПа, Т= 298 К (250С).
Абсолютное значение потенциала одного отдельно взятого электрода измерить нельзя. Определить числовое значение (φ) электродного потенциала можно только путем измерения разности потенциалов между изучаемым электродом и другим потенциалом, которого известен.
В соответствии с международным соглашением электродные потенциалы отсчитывают относительно потенциала стандартного водородного электрода принятого равным (0) нулю.
(Е) ЭДС гальванического элемента определяется как разность потенциалов его электродов Е =φ2-φ1 Это величина всегда должна быть положительной т.е. φ2>φ1 . В противном случае изменение энергии Гиббса системы (∆G)(изобарного потенциала системы) связанного с Е (ЭДС) обратной зависимостью ∆G=-nFЕ станет больше нуля, а это означает, что если ∆G>0 такой процесс термодинамически невероятен для закрытых и открытых систем.
Следовательно, в любом гальваническом элементе: а для разбавленных растворов, когда, а=с Ео/в=Е0о/в+
Е =φок –φвосст.
=Е0+
∆G =-RTInK где К константа обратимого окислительно –восстановительного процесса.
Стандартные электродные потенциалы металлов, расположенные в порядке возрастания их числовых значений называются рядом напряжений металлов:
Li; K;Сa,Na,Mg,Aℓ,Mn,Zn,Fe,Co,Ni,Sn,H2, Cu, Ag, Au,Pt.
Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак «-«, а знаком «+» отмечены стандартные потенциалы электродов, являющихся окислителями.
Ряд напряжений характеризует химические свойства металлов:
1.Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3.Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Электролиз.
ОВР, протекающие на электродах при прохождении через электролит электрического тока – электролиз.
Для осуществления электролиза необходимы:
1) источник постоянного тока (стационарный электролиз);
2) электролит – водный раствор или расплав;
3) электроды.
Электрод, соединенный с отрицательным полюсом источника тока называется катод, на нем идет процесс восстановления (присоединения электронов), находящихся в растворе ионов металла или ионов водорода (как восстановление воды). Катод является лишь передатчиком электронов. Электрод, соединенный с положительным полюсом источника тока, называется анодом, на нем происходит процесс окисления (отдача электронов). Аноды бывают: растворимые и нерастворимые, инертные, они служат для отвода электронов.
Количественные законы электролиза были установлены Фарадеем.
Первый закон. Масса веществ, выделившихся при электролизе на электродах, пропорциональна количеству прошедшего через раствор электричества и не зависит от его концентрации и температуры
m = k×qили m = k×I×t
где m– масса металла, г; k– электрохимический эквивалент; I– сила тока, А;
t – время электролиза, с; q– количество электричества = I×t. Электрохимическим эквивалентом металла называется его масса, выделяющаяся на электроде при прохождении 1 кулон электричества, и характеризует природу металла.
Второй закон. Равные количества электричества выделяют при электролизе массы веществ, пропорциональные их химическим эквивалентам:
где М– молекулярная масса; n– валентность металла; хэ = М/n;
F– число Фарадея.
Из объединенного закона Фарадея следует, что nF– количество электричества, необходимое для выделения 1 моль атома металла или генерируемое гальваническим элементом при растворении такого же количества металла. Работа электрического тока (А), генерируемого в ХИТ при растворении 1 моль металла, равна А = nFE, где E = ЭДС ХИТ.
Электродные процессы при электролизе.
Катодные процессы.
для правильного написания окислительно-восстановительных процессов, протекающих на электродах, нужно руководствоваться следующими правилами:
1. Катионы металлов, находящиеся в электрохимическом ряду напряжений после водорода при электролизе практически полностью восстанавливаются на катоде:
Меn+ +nе = Ме0 Си2+ +2е →Си0
Если в растворе есть несколько катионов, то первым выделяется металл, стоящий в ряду напряжений правее всего.
2.Катионы металлов, находящиеся в ряду напряжений до алюминия, не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды по схеме: 2Н
2О + 2е = Н2 + 2ОН-
3.Катионы металлов, находящиеся в ряду напряжений между алюминием и водородом, при электролизе на катоде восстанавливаются одновременно с молекулами воды.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом.
Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза.
Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На инертном аноде при электролизе водных растворов6
А) содержащих анионы F-, SO42-, NO3-, PO43-, OH- выделяется кислород по схеме:
в щелочной среде : 4ОН— -4е=О2+2Н2О
в кислой, нейтральной среде: 2Н2О -4е = О2+ 4Н+
Б) при окислении галогенид-ионов выделяются свободные галогены;
В)при окислении анионов органических кислот происходит процесс:
2 RСОО- -2е = R –R+2СО2
4. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах.
При электролизе водных растворов бескислородных кислот и их солей (кроме НF) у анода разряжаются анионы
На инертном или нерастворимом, аноде (графит, платина) возможны два процесса:
а) Если ионы кислотного остатка не содержат атомов кислорода, то окисляются именно они, например:
2С1 -2е → С12
б) Если ионы кислотного остатка содержат атомы кислорода то окисляются ионы ОН-:
4ОН— -4е→О2 +2Н2О
2)Если анод растворимый (медь, никель), то происходит окисление материала анода, и металл переходит в раствор в виде ионов, например:
Ni -2е→ Ni2+.
Рассмотрим электролиз водного раствора NaCl, рН=7. Анод нерастворимый.
К.: 2H2O + 2
А.: 2Cl– – 2
При электролизе расплава NaCl (графитовые электроды) идет разложение
NaCl = Na+ + Cl–, под током:
К.: Na– +

