Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 161
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Основные положения МВС.
1. В образовании связи участвуют только внешней электронной оболочки атома валентные электроны.
2. Химическая связь образуется двумя валентными электронами различных атомов с антипаралельными спинами. При этом происходит перекрывание электронных орбиталей и между атомами появляется область с повышенной электронной плотностью, обуславливающая связь между ядрами атомов. Т.о. в основе МВС лежит образование двухэлектронной , двухцентровой системы.
3. Химическая связь осуществляется в том направлении в котором обеспечивается наибольшее перекрывание атомных орбиталей (АО)
4. Из нескольких связей данного атома наиболее прочной будет связь, которая получилась в результате наибольшего перекрывания АО.
5. При образовании молекул электронная структура кроме внешней электронной оболочке и химическая индивидуальность каждого атома сохраняются.
18.Описание молекулы по методу линейной комбинации атомных орбиталей. Молекулярная орбиталь (ЛКАО-МО) Связывающие и разрыхляющие МО ( заполнение электронами МО в простейших молекулах Н2+, Н2, Не2, Не2 +2).Основные положения ММО.
19.Энергетические схемы образования молекул из одинаковых атомов (гомоядерные) и разных атомов (гетероядерные) на примере ΝО, СО, О2, F2.
20.Сравнение МВС и ММО (двухцентровые и многоцентровые связи)
Метод молекулярных орбиталей, в создании которого внес большой вклад Роберт Малликен, следует рассматривать как исследование формы электронных орбиталей в уже образовавшейся молекуле.
Метод предполагает, что при образовании химической связи изменяется состояние всех электронов во взаимодействующих атомах они становятся общими для данной молекулы. АО видоизменяется и превращается в МО.
Разница между АО и МО
Заключается в том, что АО принадлежит ядру одного атома является одноцентровой, а МО- принадлежит сразу двум или нескольким ядрам и является многоцентровой. Таким образом, электроны, находящиеся на МО обобществляется сразу всеми атомами данной молекулы (если по МВС они обобществляются только соседними).
Молекулярной орбиталью называют волновую функцию, описывающую состояние электрона в поле всех атомов данной молекулы. Однако форма и энергия МО зависит от того какие электроны участвуют в ее образовании:
а) МО, образованные внутренними (не валентными АО) взаимно не перекрываются, а значит и не изменяют своей формы, не изменившиеся АО, перешедшие в МО, называется не связывающими (МО) электроны в них обладают тем же запасом энергии что и атомы.
б) Валентные АО, вступал в взаимодействие и превращаясь в МО, становятся многоцентровыми, сложными по форме . Наглядно представить изменение формы АО при образование МО можно путем линейной комбинации волновых функцией, описывающих АО обозначим волновые функции
АО через φ
МО через ψ
Согласно методу МО молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и ядер. Метод МО распространяет квантово-механические закономерности, установленные для атомов, на более сложную систему – молекулу. В основе метода МО лежит представление об «орбитальном» строении молекул, т.е. предположение о том, что все электроны молекулы распределяются по соответствующим молекулярным орбиталям (МО). Специфика молекулярных орбиталей в том, что они являются многоцентровыми. Общее число образующихся МО равно общему числу исходных АО.
Описать молекулу по методу МО – это значит определить тип молекулярных орбиталей, их энергию и выяснить характер распределения электронов по МО. Мы рассмотрим самый простой вариант метода МО, называемый линейной комбинацией атомных орбиталей, сокращенно ЛКАО.
Согласно методу МО ЛКАО, волновая функция молекулы y±AB представляет собой линейную комбинацию атомных волновых функций yA и yB,
y±AB = с1yA+с2yB, где c1, c2 – коэффициенты, учитывающие долю участия АО в образовании молекулы.
Связывающие и разрыхляющие МО. Рассмотрим форму и относительную энергию двухцентровых МО, возникающих при линейной комбинации двух s–AO. Процесс сложения и вычитания двух s–AO показан на рис.
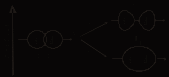 | 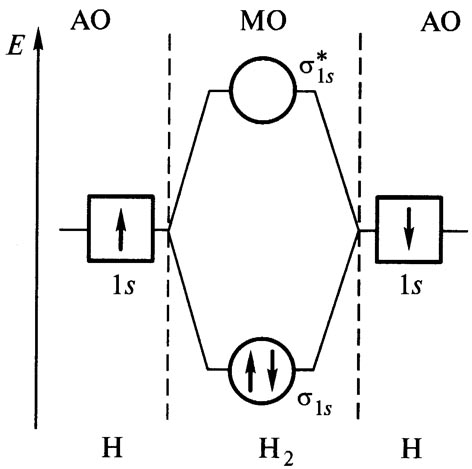 |
| Р Схема образования МО. | Рис Энергетическая схема АО и МО в системе из двух атомов водорода. |
При сложении АО образуется двухцентровая МО. Сложение означает, что МО характеризуется повышенной электронной плотностью в пространстве между ядрами и поэтому энергетически более выгодна, чем исходные АО. Такую МО называют связывающей и обозначают sS. При вычитании функций АО образуется МО, разъединенные области которой направлены в разные стороны от атомов. В этом случае электронная плотность между ядрами равна нулю. Такая МО называется разрыхляющей, она обозначается звездочкой – sS*.
Молекулы с кратными связями. p- и d-связи могут налагаться на s-связи, вследствие чего образуются молекулы с кратными связями. Например, два атома азота связаны в молекулу за счет трех ковалентных связей (NºN), одна из них s-связь, а две другие – p-связи. В линейной молекуле CO2 каждый из атомов кислорода соединяется с атомом углерода одной d- и одной p-связью:
Образование МО из АО представляют также энергетической диаграммой . Горизонтальные линии по краям диаграммы соответствуют энергиям исходных АО, а в средней части – энергиям связывающих и разрыхляющих МО.
Электроны на связывающей и разрыхляющей МО оказывают противоположное влияние на стабильность молекул: каждая занятая электронами разрыхляющая МО компенсирует одну занятую связывающую МО. Поэтому порядок (кратность) связи можно определить следующим образом:
В отличие от метода ВС по методу МО в химической связи может участвовать нечетное число электронов: один, два, три и т.д. Допускается порядок связи, равный 1/2, 3/2, 5/2 и т.д. Чтобы из АО образовались МО, необходимы следующие условия: а) близкие значения энергии АО, б) значительное перекрывание АО, в) одинаковая симметрия АО относительно оси молекулы.
| | |
| | |
Электронные формулы некоторых молекул. Для элементов второго периода перекрывание 1s1 АО незначительно по сравнению с АО внешнего 2-го уровня, поэтому АО 1s1 считают несвязывающими. Переход электронов с АО на МО и их заполнение отражает энергетическая диаграмма молекулы О
2

Энергетическая диаграмма молекулы О2.
s-электроны второго уровня 2s1 перейдут с АО на МО с образованием
р-электроны перейдут с трех АО 2рх, 2ру, 2рz на МО с образованием
Магнитные свойства молекул. Характер распределения электронов по МО позволяет объяснить магнитные свойства молекул. Собственный магнитный момент (парамагнетизм) молекул обусловлен наличием неспаренных электронов. В молекуле кислорода имеется два неспаренных электрона, поэтому она парамагнитна. Методом ВС парамагнетизм молекулярного кислорода объяснить не удается.
Строение гетероядерных молекул. Метод МО позволяет рассмотреть строение гетероядерных молекул, в состав которых входит два и более атомов различных элементов.
В молекуле СО (так же как и в молекуле N2) на внешнем уровне находится 10 электронов, в т.ч. 8 электронов на связывающих и 2 электрона на разрыхляющих МО. Порядок связи для молекул СО и N2 равен 3. Это обуславливает сходство в свойствах и параметрах молекул СО и N2.
Таким образом, метод МО успешно объясняет магнитные и оптические (спектральные) свойства различных молекул. Оба метода (МО и ВС) дополняют друг друга в описании химической связи молекул.
Сравнение МВС и ММО :
Метод ВС обладает многими достоинствами . Он относительно прост и нагляден и позволяет предсказывать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия и длина связей. Однако свойства некоторых молекул и ионов метод ВС объяснить не в состоянии. В методе ВС постулируется участие в образовании связей пары электронов, в то же время существуют свободные радикалы, молекулярные ионы, такие как Н
2+, Не2+, О2-, которые имеют неспаренные электроны. О наличии неспаренных электронов можно судить по магнитным свойствам веществ. Вещества, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле. Вещества, не имеющие неспаренных электронов, диамагнитны, т.е. выталкиваются из магнитного поля. Согласно методу ВС молекула О2 не имеет неспаренных электронов, между тем кислород парамагнитен.
Согласно методу МО электроны в молекулах распределены по молекулярным орбиталям, которые подобно АО характеризуются определенной энергией и формой В отличии от АО молекулярные орбитали охватывают не один атом , а всю молекулу, т.е. является двух или многоцентровыми. Если в методе ВС атомы молекул сохраняют определенную индивидуальность, то в методе МО молекула рассматривается как единая система. Наиболее широко в методе МО используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил.
-
Число МО равно общему числу АО из которых комбинируются МО. -
Энергия одной МО оказывается выше, других – ниже энергии исходных АО. Средняя энергия МО полученных из набора АО, приблизительно совпадает со средней энергией этих АО. -
Электроны заполняют МО, как и АО в порядке возрастания энергии, при этом соблюдается принцип запрета Паули, и Правило Гунда -
Наиболее эффективно комбинируются АО с теми АО, которые характеризуются сопоставимыми энергиями и соответствующей энергией.
21.Ионная связь. Поляризация и поляризующая способность ионов. Механизм образования, свойства. Водородная и металлическая связь.
Ионная связь, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
При образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами, или катионами; а атомы неметаллов превращаются в отрицательные ионы – анионы.

