Файл: Атомы и химические элементы. Периодический закон и периодическая система элементов Д. И. Менделеева. Изотопы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 166
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов. Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении зарядов.
Такая связь называется полярной или гетерополярной.
Н· + :С1: → Н :С1:
Способность атома данного элемента оттягивать к себе общую электронную пару характеризуется величиной относительной электроотрицательности. Чем она больше, тем сильнее атом притягивает к себе общую электронную пару, т.е. сильнее смещение общего электронного облака. В результате средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже – вблизи менее электроотрицательного. Т.е. первый атом приобретает избыточный отрицательный, а второй – избыточный положительный заряд, который называется эффективными зарядами атомов в молекуле. Так , например, в молекуле НС1 общая электронная пара смещена в сторону более электроотрицательного хлора, что приводит к возрастанию у него эффективного отрицательного (-0,18 заряда электрона), а у атома водорода – эффективного положительного (+0,18 заряда электрона). Следовательно, такая молекула является полярной, которую можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями. Хотя суммарный заряд равен «0», в окружающем его пространстве образуется электрическое поле, напряженностью которого пропорциональна дипольному моменту молекулы µ, который равен произведению абсолютного значения заряда электрона q на расстояние l между центрами положительных и отрицательных зарядов в молекуле: µ = q l
Электрический момент диполя выражается в Дебаях Д , 1Д=3,33 10 -30Кл м. Он является векторной величиной, например от отрицательного полюса диполя к положительному. q+ ← q-
Расстояние меду центрами тяжести эффективных зарядов называется длиной диполя.
В многоатомных молекулах суммарный электрический момент диполя молекулы равен векторной сумме ЭМД отдельных связей. Поэтому полярность или неполярность молекулы, определяется, ее ЭДМ зависит от симметричности распределения зарядов, т.е. от геометрической структуры молекул. Например, молекула СО
2 является неполярной вследствие линейного строения, хотя отдельные связи С-О полярны (µ= 8,9 10-29 Кл м).
q+
q- О = С = О q-
→ ←
µ µ
А молекула воды из-за своего строения является полярной:
2q-
О
q+ Н ∕ \ Н q+
Полярность связей и всей молекулы в целом может изменяться под действием внешнего электрического поля или под воздействием другой молекулы или иона. Эта способность характеризуется поляризуемостью. Т.е. неполярные молекулы могут стать полярными, а полярные в еще более полярные вплоть до полного разрыва с образованием положительных и отрицательных ионов:
Н:С1: → Н :С1: → Н+ + :С1:- такой распад называется гетеролитическим.
В случае разрыва с образованием атомов или радикалов наблюдается гомолитический разрыв:
Н : С1: → Н + С1:
Донорно-акцепторный механизм ковалентной связи. Образование ковалентной связи может происходить за счет собственной неподеленной пары электронов одного атома (иона) – донора и свободной атомной орбитали другого атома (иона) – акцептора. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Образование молекулы аммиака NН3 происходит за счет обобществления трех неспаренных электронов атома азота и одного неспаренного электрона трех атомов водорода с образованием трех общих электронных пар. В молекуле аммиака NН3 у атома азота есть собственная неподеленная пара электронов. 1s–атомная орбиталь иона водорода Н+ не содержит электронов (вакантная орбиталь). При сближении молекулы NН3 и иона водорода происходит взаимодействие неподеленной электронной пары атома азота и вакантной орбитали иона водорода с образованием химической связи по донорно-акцепторному механизму и катиона NH4+. За счет донорно-акцепторного механизма валентность азота В=4.
Н Н
Н : N: + Н+ → [Н :N:Н]+
Н Н
17.σ – π- связи. Форма молекул. Гибридизация атомных орбиталей: Śρ, Śρ2 Śρ3- гибридизация.
Область перекрывания электронных облаков – это область высокой плотности отрицательного заряда, который притягивает положительно заряженные ядра атомов.
σ- связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов.
π- связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
1) s-связь возникает при перекрывании s-s, s-p, d-d облаков вдоль по осевой линии, соединяющей центры атомов (линии связи).
2) p-связи осуществляется при перекрывании py-py, pz-pz и d-d облаков в плоскости перпендикулярно линии связи.
3) d-связи возникает при перекрывании двух d облаков, расположенных в параллельных плоскостях, перпендикулярных линии связи.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
Гибридизация атомных орбиталей.
Гибридизация атомных орбиталей – это смешение атомных орбиталей (электронных облаков) различного типа , в результате которого образуются одинаковые по форме и энергии гибридные орбитали BeCl2.

Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:

Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180о.
Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали .
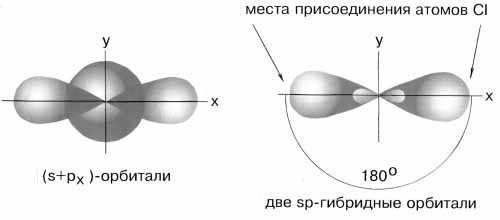
sp-гибридизация валентных орбиталей бериллия в соединении BeCl2
. Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой.
Считается, что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.
Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы BF3.
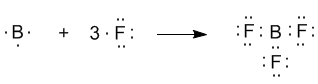
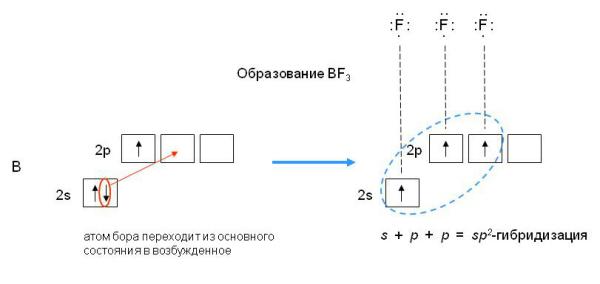

sp2-гибридизация валентных орбиталей бора в соединении BF3. Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o.
Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить молекула метана СН4.

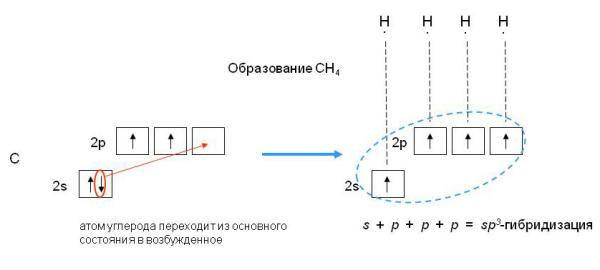
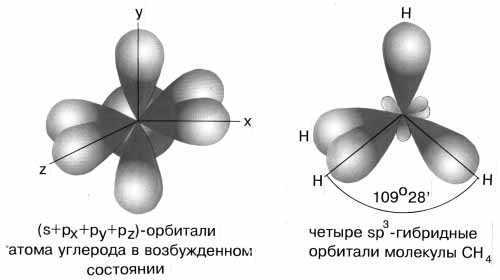
sp3-гибридизация валентных орбиталей углерода. Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'.
Существует важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов . Форма молекулы угловая, если смотреть по центрам атомов. Валентный угол HОН составляет 105
о, что довольно близко к теоретическому значению 109о.
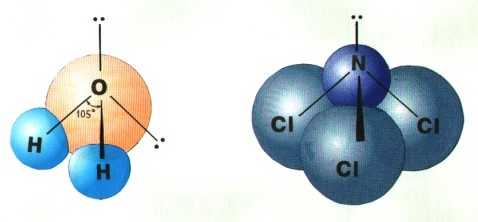
sp3-гибридизация атомов кислорода и азота в молекулах а) H2O и б) NCl3.

