Файл: Закон Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 20
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
3) Кроме того на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, между ядрами расстояния уменьшаются так, длина связи:
С-С = 0,154 нм;
С=С = 0,135 нм;
С=-С = 0, 121 нм.
Валентные углы - это углы между связи в молекуле, их схематично можно представить, как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые линии, проведенные через два ядра называют линиями связи. Величина валентного угла зависит от природы атомов и характера связи.
Простые двухатомные молекулы всегда имеют линейную структуру:
С = О
Трехатомные и более сложные молекулы обладают различными конфигурациями:
Например, в молекуле Н2О угол между линиями связи Н-О = 104,5 градусов.

О
Н Н
Т.е. валентный угол – это есть угол между направлениями связей данного атома с другими атомами в молекуле.
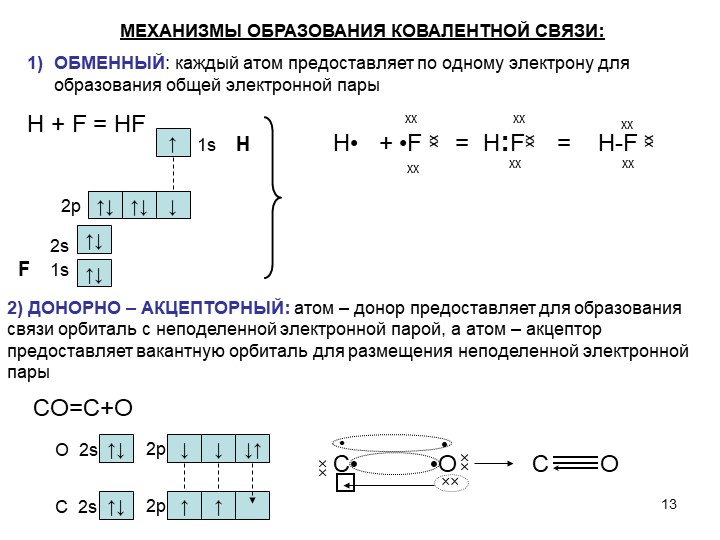
4) Ковалентная связь. Основные положения метода валентных связей (МВС). Полярная и неполярная ковалентная связь. Механизмы образования.
Двухэлектронная, двухцентровая химическая связь, осуществляемая электронными парами, называется ковалентной.
Метод валентных связей (МВС). Ковалентная связь.
Основным универсальным типом химической связи является ковалентная связь.
а) Ковалентная связь между двумя взаимодействующими атомами осуществляется за счет образования общей электронной пары. Каждый из атомов предоставляет на образование общей электронной пары один неспаренный электрон:

Таким образом, по методу ВС химическая связь двухцентровая и двухэлектронная.
 б) Общая электронная пара может образоваться только при взаимодействии электронов с антипараллельными спинами:
б) Общая электронная пара может образоваться только при взаимодействии электронов с антипараллельными спинами:в) При образовании ковалентной связи происходит перекрывание электронных облаков. В области перекрывания облаков электронная плотность максимальна, т.е. вероятность пребывания двух электронов в пространстве между ядрами значительно больше, чем в других местах. Возникает система, в которой два ядра электростатически взаимодействуют с парой электронов. Это приводит к выигрышу в энергии, и система становится более устойчивой, образуется молекула. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Ковалентной связью называется связывание атомов с помощью общих электронных пар, поделенных между ними.
Различают две разновидности ковалентной связи: неполярную и полярную.
Если двухатомная молекула состоит из атомов одного элемента, например, О2, Сl2, N2, то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распространяется в пространстве симметрично относительно ядер обоих атомов. Такая связь называется неполярной или гомеополярной (например, молекула хлора).
Рассмотрим связывание двух атомов хлора (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора.
На внешнем электронном уровне хлора содержится 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего, третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:

При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участия в связывании.
Атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении зарядов.
Такая связь называется полярной или гетерополярной.

5) Свойства ковалентной связи: длина, насыщаемость, направленность. Диполь, дипольный момент.
Свойства ковалентной связи:
Насыщенность - способность атомов образовывать определённое число ковалентных связей, то есть одна орбиталь атома может принимать участие в образовании только одной ковалентной связи.
Направленность - способность ковалентной связи, определяющее геометрическую структуры молекулы.
Причина направленности объясняется тем, что перекрывание электронных орбиталей возможно, только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания.
Полярность - способность разрыва ковалентная связи.
В силу того, что у полярной молекулы электроны смещены в сторону более электроотрицательного атома - центры тяжести положительных и отрицательных зарядов -не совпадают в результате образуются электрический диполь.
Способность атома данного элемента оттягивать к себе общую электронную пару характеризуется величиной относительной электроотрицательности. Чем она больше, тем сильнее атом притягивает к себе общую электронную пару, т.е. сильнее смещение общего электронного облака. В результате средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного. Т.е. первый атом приобретает избыточный отрицательный, а второй — избыточный положительный заряд, который называются эффективными зарядами атомов в молекуле. Так, например, в молекуле НСl общая электронная пара смещена в сторону более электроотрицательного хлора, что приводит к возрастанию у него эффективного отрицательного (-0,18 заряда электрона), а у атома водорода — эффективного положительного (+0,18 заряда электрона) зарядов. Следовательно, такая молекула является полярной, которую можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями. Хотя суммарный заряд равен «0», в окружающем его пространстве образуется электрическое поле, напряженность которого пропорциональна дипольному моменту молекулы μ, который равен произведению абсолютного значения заряда электрона q на расстояние l между центрами положительных и отрицательных зарядов в молекуле:
μ=ql
Электрический момент диполя выражается в Дебаях, 1Д=3,33*10-30 Кл/м. Он является векторной величиной, например, от отрицательного полюса к положительному.
Если µ=0 - молекула неполярна и имеет линейную структуру.
Например, молекула СО2 является неполярной вследствие линейного строения, хотя отдельные связи С-О плярны.
Если µ≠0 - молекула полярна и имеет угловую структуру.
Например, в молекуле Н2О µ≠0 и она является полярной.

Способы разрыва ковалентной химической связи делятся на два типа:
1) Гомолитический;
2) Гетеролитический.
Чтобы разорвать химическую связь, необходимо затратить столько энергии, сколько выделось при ее образовании.
При гомолитическом разрыве ковалентной связи электронная пара, осуществляющая химическую связь, разрывается и с каждым атомом остается по одному электрону, т.е. разрыв с образованием радикалов.

При гетеролитическом разрыве химической связи электронная пара целиком переходит к одному из атомов (более электроотрицательному), в результате чего образуется два иона.

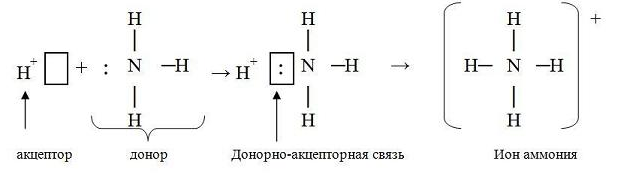
6) Ионная связь. Поляризация и поляризующая способность ионов. Механизм образования, свойства. Водородная и металлическая связь.
Ионная связь, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
При образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами, или катионами; а атомы неметаллов превращаются в отрицательные ионы – анионы.
Связь между ионами называется ионной связью.
Энергия, которая требуется для разрыва связи, называется энергией химической связи.
Рассмотрим конкретный пример: реакцию между атомами натрия (Z=11) и фтора (Z=9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z=10). Для того, чтобы убедиться в этом надо записать электронные формулы всех трех элементов:
Na: 1S2 2S2 2P6 3S1
F: 1S2 2S2 2P5
Ne: 1S2 2S2 2P6
В электронных формулах нам важны только электронные конфигурации внешних электронных уровней (они подчеркнуты):
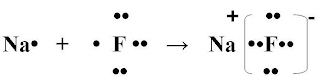
Натрий, отдав фтору свой 3S1 электрон, становится ионом Na+ и остается c заполненной 2S2 2P6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретет атом F, приняв один электрон, отданный натрием теперь это ион F-. Разумеется, при этом ионы Na+ и F- продолжают оставаться все теми же элементами фтором и натрием, потому что никакие электронные переходы не могут изменить природу элемента – число протонов в его ядре:
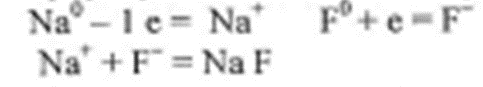
В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления.
Система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью.
Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака.
Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Причиной поляризации всегда служит действие электрического поля, смещающего электроны и ядра атомов в противоположных направлениях. Каждый ион, будучи носителем электрического заряда, является источником электрического поля. Поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга.

