Файл: Закон Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 19
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Наибольшее смещение испытывают при поляризации электроны внешнего слоя; в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Однако под действием одного и того же электрического поля различные ионы деформируются в разной степени. Иначе говоря, поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, так как внешние электроны удаляются все дальше от ядра, экранируются все большим числом электронных слоев и, в результате, слабее удерживаются ядром. Так, у ионов щелочных металлов поляризуемость возрастает в ряду:
Li+ < Nа+ < К+ < Rb+< Сs+
Точно также поляризуемость ионов галогенов изменяется в следующем порядке:
F- < Сl- < Вr- < I-
Превращение атома в положительно заряженный ион всегда приводит к уменьшению его размеров. Кроме того, избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков. Напротив, отрицательно заряженные ионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, к ослаблению их связи с ядром. По этим причинам поляризуемость анионов, как правило, значительно выше поляризуемости катионов.
Поляризующая способность ионов, т. е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле, следовательно, наибольшей поляризующей способностью обладают многозарядные ионы. При одном и том же заряде напряженность электрического поля вблизи иона тем выше, чем меньше его размеры. Поэтому поляризующая способность ионов одинакового заряда и аналогичного электронного строения падает с увеличением ионного радиуса. Так, в ряду катионов щелочных металлов поляризующая способность изменяется в порядке, обратном порядку изменения поляризуемости:
Li+ > Nа+ > К+ > Rb+ > Сs+ .
Металлическая связь.
Существенные сведения о природе химической связи в металлах можно получить на основании их двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электрической проводимостью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами.
Из первого характерного свойства металла следует, что по крайней мере часть электронов может передвигаться по всему объему куска металла. Из второго свойства металлов следует. Что их атомы не связаны друг с другом локализованными двухэлектронными связями. Число валентных электронов атома металла недостаточно для образования подобных связей со всеми его соседями.
Природу химической связи и характерные особенности металлов можно объяснить на примере лития следующим образом. В кристалле лития орбитали соседних атомов перекрываются. Каждый атом предоставляет на связь четыре валентные орбитали и всего лишь один валентный электрон.
Значит. В кристалле металла число электронов значительно меньше числа орбиталей. Поэтому электроны могут переходить из одной орбитали в другую. Тем самым электроны принимают участие в образовании связи меду всеми атомами кристалла металла. К тому же атомы металлов характеризуются невысокой энергией ионизации – валентные электроны слабо удерживаются в атоме, т.е. легко перемещаются по всему кристаллу. Возможность перемещения электронов по кристаллу определяет электрическую проводимость металла.
Таким образом, в отличие от ковалентной и ионных соединений в металлах небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле. Иначе говоря, в металлах имеет место сильно делокализованная химическая связь.
Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке – называется металлической.
Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме.
Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального.
Металлическая связь характерна для металлов твердом и жидком состоянии.
Водородная связь.
Водородная связь представляет собой результат электростатического притяжения положительно поляризованных атомов водорода к отрицательному полюсу полярных молекул.
Образование водородной связи обязано ничтожно малому размеру положительно поляризованного атома водорода и его способности глубоко внедряться в электронную оболочку соседнего (ковалентно с ним не связанного отрицательно поляризованного атома). Вследствие этого при взаимодействии водородной связи наряду с электростатическим взаимодействием проявляется и донорно-акцепторное взаимодействии.
Энергия связи водородной связи Н---О в димере воды составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
7) Полярность ς- и π- связи. Форма молекул.
Область перекрывания электронных облаков — это область высокой плотности отрицательного заряда, который притягивает положительно зараженные ядра атомов.
ς-связи - это ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов.
π-связи - это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
1) ς-связь возникает при перекрывании s-s, s-p, d-d облаков вдоль по осевой линии,
соединяющей центры атомов (линии связи).
2) π-связи осуществляются при перекрывании рy -рy, рz -рz и d-d облаков в плоскости
перпендикулярно линии связи.
3) связи возникают при перекрывании двух d-d облаков, расположенных в параллельных
плоскостях, перпендикулярных линии связи.
Порядок связи — это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
8) Гибридизация атомных орбиталей: Sp1-, Sp2-, Sp3 – гибридизация.
Возбуждение атомов приводит к тому, что у них появляются орбитали, способные к образованию химических связей (валентные орбитали).
Как правило эти орбитали получаются различных типов (s,p,d,f), и следовательно обладают различными энергиями и казалось бы связи в таких молекулах как ВеСI2, ВСI3, ССI4 должны были быть разные, но они одинаковы, что противоречит в свою очередь эквивалентности химической связи в молекуле т.е. все связи в молекуле – одинаковы.
Для объяснения этих фактов в методе валентных связей вводится понятие гибридизация.
Гибридизация – это изменение формы всех валентных орбиталей таким образом, что они приобретают одинаковую конфигурацию, обеспечивающую наибольший уровень перекрывания с орбиталями других атомов. А образующиеся в результате орбитали называются –гибридными.
Гибридизация атомных орбиталей – это смешение атомных орбиталей (электронных облаков) различного типа , в результате которого образуются одинаковые по форме и энергии гибридные орбитали .

Электронная конфигурация валентной оболочки бериллия. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние:

Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под одинаковым углом.
Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали.

Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой, под углом 180 градусов.
Считается, что благодаря sp-гибридизации молекула имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.
Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизации орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы.
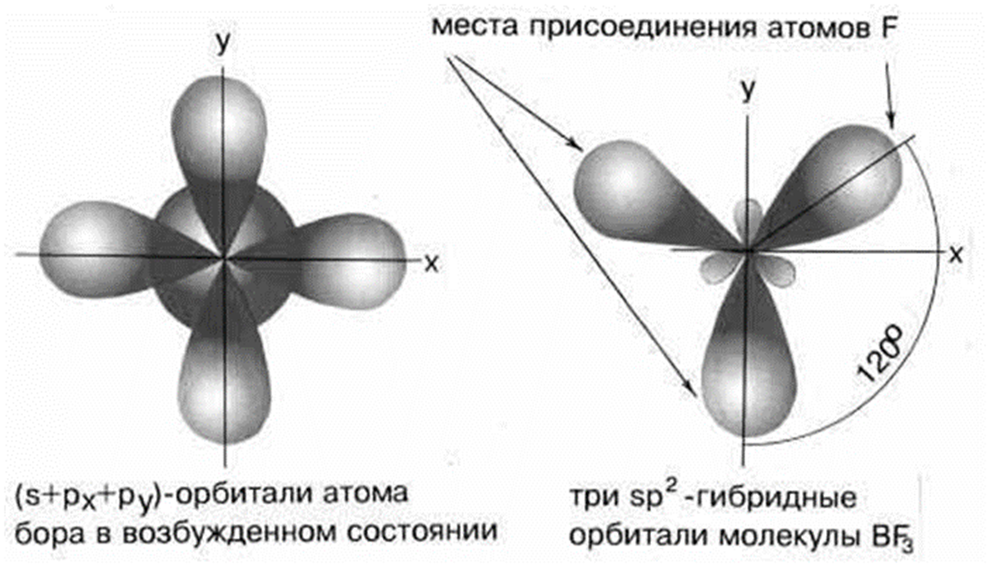
Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120 градусов.
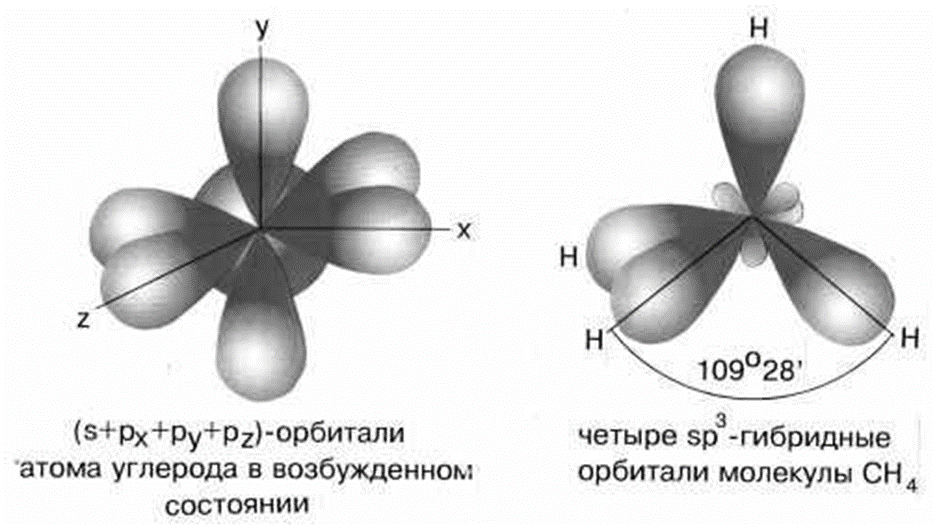
Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра. Примером может служить молекула метана.


Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°.
Существует важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
| Тип гибридизации и форма молекул. | |||
| | Гибридизация | Геометрическая форма молекул. | Угол между связями |
| Основные типы | sp | линейная | 180° |
| sp2 | треугольная | 120° | |
| sp3 | тетраэдрическая | 109°28' | |
| Другие типы | sp2d | октаэдрическая | 90° |
| sp3d | треугольно-бипирамидальная | 90° и 120° | |
| sp3d2 | квадратная | 90° и 180° | |
| И т.д. | |||
9) Описание молекулы по методу линейной комбинации атомных орбиталей. Молекулярная орбиталь. Связывающие и разрыхляющие МО. Основные положения (ЛКАО-МО).
10) Энергетические схемы образования молекул из одинаковых атомов (гомоядерные) и разных атомов (гетероядерные) на примере NO, CO, O2, F2. По методам МВС и ММО и сравнение этих методов.
Для описания ковалентной связи используются два взаимодополняющих и квантовомеханических метода: МВС (метод валентных связей) и ММО (метод молекулярных орбиталей).

