Файл: Отчет по лабораторной работе 7 По дисциплине химия наименование.docx
Добавлен: 10.04.2024
Просмотров: 12
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей и физической химии
Отчет по лабораторной работе №7
По дисциплине ХИМИЯ
(наименование учебной дисциплины согласно учебному плану)
Тема: Исследование скорости химических реакций и химического равновесия
Автор: студентка гр. ИЗБ-22-1 /Сень С.С./
(шифр группы) (подпись) (Ф.И.О.)
ОЦЕНКА:
Дата: 14 декабря 2022 г.
ПРОВЕРИЛ
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2022 г
Цель работы: изучить зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомиться с влиянием концентрации реагентов на химическое равновесие.
Оборудование и реактивы:
В лаборатории: термометр, пробирки − 7 шт., химический стакан объемом 150 мл; мел (карбонат кальция). В штативе: тиосульфат натрия − 1 н. раствор, серная кислота − 2 н. раствор, роданид (тиоцианат) аммония − 0,5 н. раствор, хлорид железа (III) − 0,5 н. раствор, роданид аммония − 0,0025 н. раствор, хлорид железа (III) − 0,0025 н. раствор, сульфат меди − 1 н. раствор, хлорид аммония − кристаллический.
В вытяжном шкафу: соляная кислота – 15% раствор.
Выполнение работы:
Опыт 1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде.
Таблица 1. Экспериментальные данные
| Номер пробирки | C(Na2S2O3), отн. ед. | Время реакции t, с |
| 1 | 1 (4/13) | 90 |
| 2 | 2 (8/13) | 47 |
| 3 | 3(12/13) | 36 |
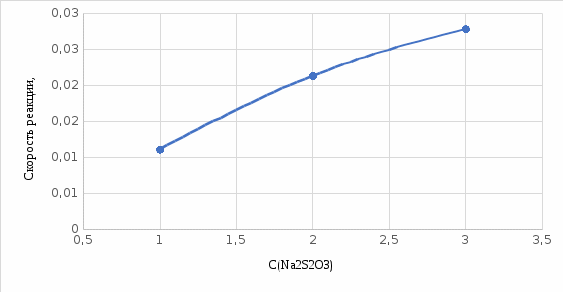
Таблица 2. Зависимость скорости реакции от концентрации тиосульфата натрия
| Номер пробирки | C(Na2S2O3), отн. ед. | 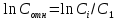 | Время реакции t, с | Скорость реакции, 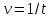 , , 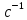 |
| 1 | 1 | 0 | 90 | 0,0111 |
| 2 | 2 | 0,693 | 47 | 0,0213 |
| 3 | 3 | 1,10 | 36 | 0,0278 |


Рисунок 2. График зависимости в координатах lnCосн - t
Рисунок 1. График зависимости скорости реакции от концентрации тиосульфата натрия
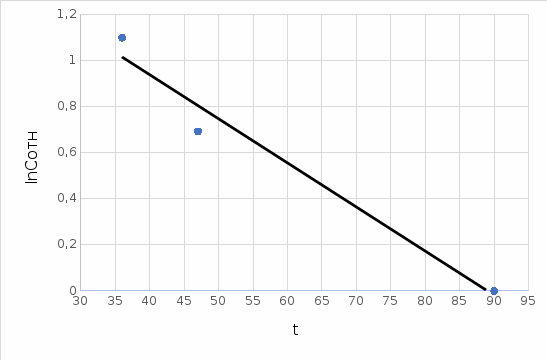
 Тангенс угла наклона прямой:
Тангенс угла наклона прямой: 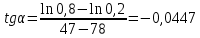
Кинетическое уравнение:
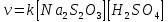
Вывод: С увеличением концентрации тиосульфата натрия скорость его разложения возрастает.
Опыт 2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
Таблица 3. Экспериментальные данные
| Номер пробирки | Температура °C | Время реакции t, с |
| 1 | 21 | 55 |
| 2 | 32 | 37 |
| 3 | 40 | 30 |
Таблица 4. Зависимость скорости реакции от температуры
| № п/п | Температура T, К | Время реакции t, с | Скорость реакции, 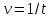 , , 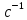 | 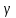 | Ea кДж/моль |
| 1 | 294,15 | 55 | 0,018 | 1,5 | 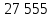 |
| 2 | 305,15 | 37 | 0,02703 | ||
| 1,23 | 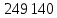 | ||||
| 3 | 313,15 | 30 | 0,333 |
Расчеты:
При обработке результатов эксперимента воспользуемся правилом Вант-Гоффа:
При увеличении температуры на 10 K скорость химических реакций возрастает в 2 – 4 раза.
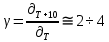 ,
, где γ – температурный коэффициент скорости реакции.
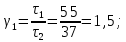
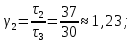
 = (1,5+1,23)/2=1,365
= (1,5+1,23)/2=1,365Путем проведения опыта было подтверждено эмпирическое правило Вант-Гоффа.
Теперь вычислим энергию активации реакции:
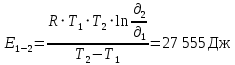
где R = 8,314 Дж/моль*K, T – температура в K,
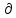 i = скорость химической реакции.
i = скорость химической реакции. =
=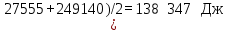
Опыт 3. Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
Таблица 5. Экспериментальные данные
| Номер пробирки | Состав системы | Время t, с |
| 1 | Мел кусочком + HCl | 360 |
| 2 | Мел в порошке + HCl | 120 |
Уравнение реакции:
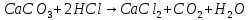
Вывод: мел в порошке растворяется быстрее, т.к. площадь взаимодействия кислоты с веществом в этом случае больше.
Опыт 5. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония.
| Номер пробирки | Состав системы | Добавленный реактив | Наблюдения |
| 1 | 5 капель 0,0025Н FeCl3 5 капель 0,0025Н NH4CNS | нет | - |
| 2 | FeCl3 | цвет изменился на красный; химическое равновесие сместилось вправо | |
| 3 | NH4CNS | цвет изменился на рыжий; химическое равновесие сместилось вправо | |
| 4 | NH4Cl | раствор обесцветился; химическое равновесие сместилось влево |
Уравнение реакции:
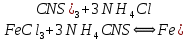
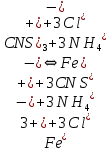
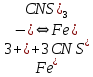
Вывод: концентрация реагирующих веществ влияет на химическое равновесие так, что при увеличении концентрации реагентов равновесие смещается вправо, при увеличении концентрации продуктов – влево.
Вывод: Выполнив данную лабораторную работу, изучил зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомился с влиянием концентрации реагентов на химическое равновесие.


