Файл: Отчет производственной практики (по профилю специальности) пм03 Планирование и организация работы.docx
Добавлен: 11.04.2024
Просмотров: 17
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Чистые зоны при производстве стерильных лекарственных средств подразделяются на четыре типа:
А - локальная зона для проведения операций, представляющих высокий риск для качества продукции, например: зоны наполнения, укупорки, вскрытия ампул и флаконов, соединения частей оборудования в асептических условиях;
В - зона, непосредственно окружающая зону А и предназначенная для асептического приготовления и наполнения;
С и D - чистые зоны для выполнения менее ответственных стадий производства стерильных лекарственных средств.
Помещения 1-го класса чистоты предназначаются для выгрузки и наполнения стерильных ампул. В помещениях 2-го класса проводится приготовление растворов, фильтрование, мойка флаконов, сушка и стерилизация. Помещение 3-го класса - для мойки и стерилизации вспомогательных материалов. В помещениях 4-го класса осуществляется мойка дрота, выделка ампул и др.
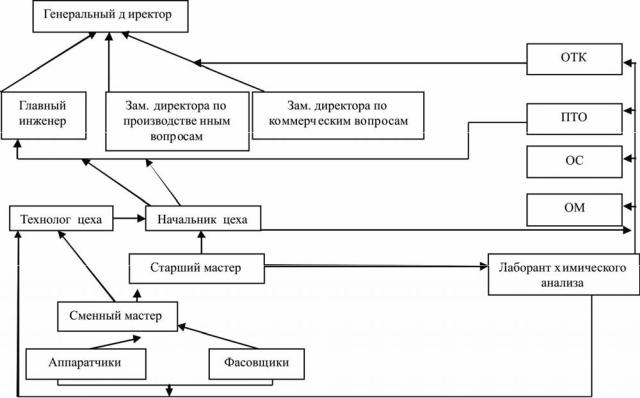
4. Оперативное планирование работ персонала цеха №3.
Надлежащее производство лекарственных средств зависит от персонала. Поэтому на предприятии должно быть достаточное количество квалифицированного персонала для решения всех задач, находящихся в сфере ответственности производителя. Каждый сотрудник должен понимать индивидуальную ответственность, которая должна быть документирована. Весь персонал должен знать принципы GMP, касающиеся его деятельности, а также пройти первичное и последующее обучение в соответствии с его обязанностями, включая инструктаж по выполнению гигиенических требований.
Общие требования. Производитель должен иметь достаточное количество сотрудников с необходимой квалификацией и практическим опытом работы. Высшее руководство должно определять и обеспечивать достаточные и надлежащие ресурсы (человеческие, финансовые, материальные, а также помещения и оборудование) для внедрения и поддержания системы управления качеством и постоянного повышения ее эффективности. Обязанности любого сотрудника не должны быть чрезмерными, чтобы исключить возможность возникновения рисков для качества продукции.На предприятии должна быть схема организационной структуры, в которой отношения между руководителями производства, контроля качества и, где это применимо, руководителем подразделения обеспечения качества или подразделения по качеству. Обязанности руководящих работников и соответствующие полномочия для их выполнения должны быть определены и прописаны в должностных инструкциях. Их обязанности могут быть переданы назначенным заместителям, обладающим достаточным уровнем квалификации. Круг обязанностей персонала должен охватывать все стороны GMP, однако не должно быть необоснованного дублирования сфер ответственности.
Высшее руководство несет основную ответственность за обеспечение эффективной системы управления качеством для достижения целей в области качества, а также за то, что роли, обязанности и полномочия определены, доведены до сведения персонала и осуществляются в рамках всей организации. Высшее руководство должно установить политику в области качества, которая описывает общие намерения и направления деятельности компании, связанные с качеством и должно обеспечить постоянную пригодность и эффективность системы управления качеством и соответствие GMP путем участия в анализе со стороны руководства.
Ключевой персонал. Высшее руководство должно назначить ключевой руководящий персонал, включая руководителя производства и руководителя подразделения контроля качества, и достаточное количество, но, по крайней мере, одно Уполномоченное лицо, если руководитель производства и/или руководитель подразделения контроля качества не отвечает за обязанности, предусмотренные для Уполномоченного лица.
Ключевой руководящий персонал, как правило, должен работать полный рабочий день. Руководители производства и подразделения контроля качества должны быть независимы друг от друга. В больших организациях может возникнуть необходимость передать другим сотрудникам отдельные функции. Кроме того, в зависимости от размера и структуры организации может быть отдельно назначен руководитель подразделения обеспечения качества или руководитель подразделения качества. Обязанности Уполномоченного лица: a) для лекарственных средств, произведенных на территории государств-членов Союза, Уполномоченное лицо должно убедиться, что каждая серия была произведена и проверена в соответствии с законодательством, действующим в данном государстве-члене и в соответствии с требованиями регистрационного досье
Уполномоченное(ые) лицо(а) перед выпуском любой серии должно(ы) документально подтвердить, что все необходимые операции выполнены, и что каждая серия соответствует установленным требованиям. Образование, обучение и стаж работы Уполномоченных лиц должны соответствовать установленным требованиям Союза. Они должны постоянно и непрерывно находиться в распоряжении владельца лицензии на производство для выполнения своих обязанностей. Обязанности Уполномоченного лица могут быть переданы только другому Уполномоченному(ым) лицу(ам).
5. Выполнение правил техники безопасности, производственной и трудовой дисциплин, трудового распорядка в цехе №3.
Оборудование, используемое для производства и контроля качества лекарственных средств сконструировано и размещено так, чтобы максимально облегчить его подготовку к работе, эксплуатацию и обслуживание.
Вид, размер и характеристики оборудования соответствуют проводимым технологическим процессам.
К конструкции оборудования предъявляются определенные требования:
-
Поверхности оборудования, соприкасающиеся с исходным сырьем, полупродуктами или готовым продуктом, гладкие и изготовлены из нетоксичного, стойкого к коррозии материала, который не реагирует с используемым сырьем или материалами и выдерживает обработку дезинфицирующими средствами и/или стерилизацию; -
Все детали оборудования, контактирующие с используемыми сырьем, материалами и полупродуктами, съемные для облегчения их мойки, обработки дезинфицирующими средствами или стерилизации; -
Оборудование не загрязняется материалами, используемыми для его эксплуатации (например, смазочными веществами) во избежание ухудшения качества и загрязнения готовых продуктов; -
Все передающие устройства (транспортеры, цепные передачи, приводы трансмиссии) закрыты или отгорожены; -
Бункеры, емкости и аналогичное оборудование закрыто.
Кроме того, конструкция оборудования должна:
• минимизировать риск ошибок, предусматривать проведение эффективной уборки и обслуживания с целью предотвращения перекрестного загрязнения, появления пыли и грязи и, в общем случае, устранения любого фактора, ухудшающего качество продукции;
обеспечивать удобство и возможность его очистки.
Операции по очистке оборудования должны выполняться в соответствии с подробными письменными инструкциями.
Оборудование необходимо содержать в сухом и чистом виде, инвентарь и материалы для очистки не должны быть источниками загрязнения.
Оборудование размещено таким образом, чтобы:
-
оптимизировать потоки исходного сырья, материалов и свести к минимуму перемещение персонала; -
предотвратить возможность загрязнения лекарственных средств в процессе их производства; -
предотвратить риск смешивания разных продуктов или исключения какой-либо из стадий производственного процесса; -
облегчить мойку, обработку, эксплуатацию и обслуживание оборудования.
Неисправное оборудование должно быть удалено из производственных помещений и помещений отдела контроля качества или, в крайнем случае, должно быть отделено и четко соответствующим образом промаркировано до его удаления из помещения.
Технологическая линия в цехе №3 включает весовую и комнату прокаливания, отделение водоподготовки и получения воды для инъекций, отделения накопления упаковки, мойки, розлива, укупорки, стерилизации полупродукта, термальной обработки и обеззараживания. Среди вспомогательных помещений (помимо помещения персонала) - передаточные камеры и шлюзы, отделения стирки и сушки спецодежды, моечные, весовые, приборные и дозовочные комнаты, боксы и прочее. Также были оборудованы химическая и бактериологическая лаборатории.
Конструкция, установка и расположение оборудования, мест соединения и зон обслуживания должны предусматривать возможность работы с оборудованием, его техническое обслуживание и ремонт снаружи чистой зоны. В случае необходимости проведения стерилизации ее следует выполнять после максимально полной разборки оборудования.
Если при проведении технического обслуживания или ремонта оборудования, находящегося в чистой зоне, был нарушен уровень чистоты (стерильности), то перед возобновлением производства следует выполнять соответствующую очистку, дезинфекцию и/или стерилизацию этого оборудования (зоны).
Получение воды требуемого качества должно гарантироваться проектом, конструкцией, монтажом и техническим обслуживанием систем подготовки и распределения воды. Не допускается эксплуатация оборудования подготовки воды сверх проектной мощности. Приготовление, хранение и распределение воды для инъекций следует выполнять так, чтобы исключить рост микроорганизмов, например, за счет постоянной циркуляции воды при температуре выше плюс 70°С.
6. Выводы и рекомендации по совершенствованию организации работы цеха №3.
Вывод: изучила особенности промышленного изготовления инфузионных лекарственных средств, познакомилась с должностными инструкциями, провела анализ системы организации труда в подразделении и конкретного рабочего места, приняла участие в расчете цеховой и полной себестоимости готовой продукции.
Совершенствование технологического процесса происходит благодаря использованию современных производственных модулей, разработке новых современных приборов и аппаратов (мерники-смесители, фильтрующие установки, установки ламинарного потока воздуха, стерилизующие аппараты, приборы для контроля отсутствия механических включений и др.);
Список используемой литературы.
1.И.И. Краснюк, Г.В. Михайлова «Фармацевтическая технология» Москва, «Академия» 2006г.Для высшего профессионального образования
2.И.И. Краснюк, Г.В. Михайлова «Практикум по технологии лекарственных форм» Москва, «Академия» 2006г. Для высшего профессионального образования
3.И.А.Муравьев. Технология лекарств. В 2х томах. М.Медицина.1980г.
4.Т.С.Кондратьева «Технология лекарственных форм» в 2х томах М. Медицина 1991г.
5.Т.П. Прищеп, В.С. Чухалин «Основы фармацевтической биотехнологии» Ростов-на-Дону, Издательство НТЛ, Сибирский Государственный Медицинский Университет, 2006 год.
6.Руководство к лабораторным занятиям по аптечной технологии лекарственных форм. Под редакцией Т.С. Кондратьевой. М.Медицина 1986.
7. Меньшутина Н.В., Мишина Ю.В. и др. «Инновационные технологии и оборудование фармацевтического производства» - в 2-х Т., М.: Издательство БИНОМ, 2013.
8. https://www.business.ru/article/2254-ustav
9. https://studfile.net/preview/7668645/
10.https://www.gd.ru/articles/8037-normirovanie-truda
Приложение