Файл: 1. Классификация материалов по электрическим свойствам. Виды проводников, полупроводников, диэлектриков с примерами.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.04.2024
Просмотров: 22
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1. Классификация материалов по электрическим свойствам. Виды проводников, полупроводников, диэлектриков с примерами.
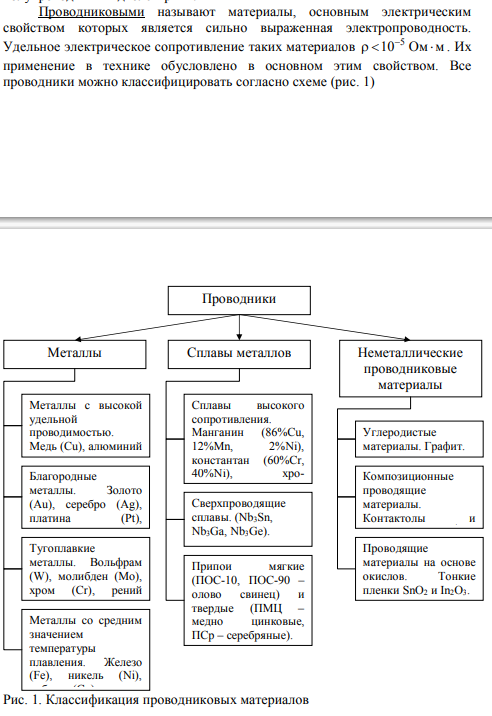


2. Классификация диэлектриков. Виды активных и пассивных диэлектриков. Краткое описание активных диэлектриков.
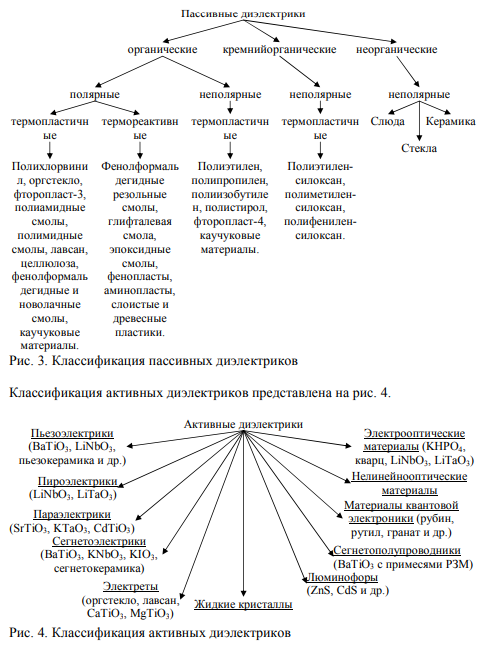

3. Классификация материалов по магнитным, структурным свойствам, агрегатному состоянию и типам химических связей.


4. Строение атома. Энергия атома. Принцип Паули. Квантовые числа
Согласно современным представлениям атомы имеют центральное ядро, состоящее из незаряженных нейтронов и положительно заряженных протонов, окруженное облаком отрицательно заряженных электронов. Атом электрически нейтрален, поскольку суммарный заряд электронов равен положительному заряду протонов. Электроны относятся к категории микрочастиц, которым присущ принцип дуализма, то есть они обладают как свойствами частицы, так и свойствами волны. Простейшей и наиболее наглядной моделью атома является модель Нильса Бора, в которой электроны уподобляются шарикам, вращающимся вокруг ядра по определенным орбитам.


5. Типы химических связей. Энергия связи
Виды химической связи
1. Ионная связь или электровалентная связь
Обусловлена переносом валентных электронов с одного атома на другой с образованием положительных и отрицательных ионов. Между этими ионами возникает электростатическое взаимодействие. Устойчивое состояние ионов в узлах достигается при равенстве сил притяжения и отталкивания. Ионная связь характерна для соединений металлов с неметаллами, например, NaCl. Частично ионная связь проявляется в полупроводниках типа InSb, GaAs.
2. Ковалентная связь
Гомеополярная связь, возникающая между двумя атомами одного сорта, при обобществлении принадлежащих им электронов. В этом случае уже нельзя говорить о принадлежности электрона одному из атомов: электроны принадлежат одновременно нескольким атомам, образующим молекулу или твердое тело. В зависимости от того, симметричную или асимметричную структуру имеют молекулы, они могут быть неполярными и полярными. В полярных молекулах центры положительных и отрицательных зарядов находятся на некотором расстоянии друг от друга, в результате чего образуется диполь.
3. Металлическая связь
Разновидность гомеополярной связи, реализующаяся в металлах. При сближении атомов и образовании кристаллов металлов волновые функции валентных электронов перекрываются, т.е. образуется “газ” свободных электронов. При этом атомы, отдавшие свои электроны, превращаются в положительные ионы, силы отталкивания между которыми уравновешиваются силами притяжения между ионами и электронами. В результате такой связи образуется кристаллическая структура, в которой атомы металла находятся на строго определенном расстоянии друг от друга в среде коллективизированных электронов. С одной стороны, свободные электроны будут обладать большей кинетической энергией при сжатии электронного газа, а с другой стороны потенциальная энергия при этом будет уменьшаться. Равновесная плотность электронов, а, следовательно, и минимум полной энергии будут определять структуру кристалла металла
4. Молекулярная связь
Обусловлена взаимодействием между молекулами, образующими молекулярный кристалл. Это взаимодействие поддерживается Ван-дер-ваальсовскими силами, удерживающими атомы соседних молекул в определенном пространственном положении, когда в любой момент времени электроны соседних молекул максимально удалены друг от друга и максимально приближены к положительным зарядам ядер соседних молекул. Атомы внутри молекулы объединены ковалентными связями.
По характеру химических связей кристаллы делятся на четыре основные группы:
1) ионные кристаллы (например, NaCl);
2) ковалентные (например, алмаз, кремний);
3) металлические (металлы и полиметаллы);
4) молекулярные кристаллы (например, нафталин).
ЭНЕ́РГИЯ СВЯ́ЗИ, минимальная энергия, которую необходимо затратить для удаления составных частей (частиц) квантовой системы на бесконечное расстояние друг от друга; определяется взаимодействием между частицами, входящими в систему. Для устойчивых систем Э. с. характеризует прочность системы: чем больше Э. с., тем прочнее система.
Для атомных ядер Э. с. определяется сильным взаимодействием нуклонов в ядре. Для ядер с массовым числом А> 20 Э. с. нуклонов составляет ок. 8 МэВ/нуклон. Э. с. может выделяться при слиянии лёгких ядер в более тяжёлое ядро (см. Термоядерные реакции). Э. с. электрона в атомах и ионах определяется его взаимодействием с ядром и электронами атомного остатка (атомного остова). Э. с. электронов внешних атомных оболочек систем, находящихся в основном состоянии, совпадает с энергией ионизации, а для избыточного электрона отрицательных ионов характеризует сродство к электрону. Э. с. электронов внутр. оболочек растёт по мере приближения оболочки к ядру, что связано с влиянием не скомпенсированного др. электронами атомной системы кулоновского поля ядра. В случае молекул Э. с. определяется взаимодействием атомов, входящих в молекулу (см. Химическая связь). Энергия химич. связи составляет обычно порядка сотен кДж/моль.
6. Кристаллическая структура твердых тел.
Кристаллы
Основным свойством кристаллической решетки является трехмерная периодичность в расположении атомов или молекул.
Геометрические места их расположения называются узлами кристаллической решетки.
Существование кристаллической решетки объясняется тем, что равновесие сил притяжения и отталкивания между атомами, соответствующее минимуму потенциальной энергии, достигается при условии трехмерной периодичности. Минимальная часть кристалла, образованная тремя векторами, а, b, с, называется элементарной ячейкой, причем эти векторы направлены вдоль ребер кристалла. Повторение решетки путем параллельных переносов (трансляций) создает всю кристаллическую решетку.
Элементарные ячейки имеют вид параллелепипедов
Кристаллографические решетки классифицируются по наличию в них различных элементов симметрии.
Симметрия кристалла состоит в возможности его совмещения с собой при поворотах, отражениях или параллельных переносах. Симметрия внешней формы (огранка) монокристалла определяется симметрией его кристаллической решетки. Кристаллу могут быть присущи несколько операций симметрии: поворот вокруг оси симметрии, зеркальное отражение, инверсионный поворот. Поворот кристалла на угол = 2/N, который переводит любой элемент кристаллической решетки в эквивалентное состояние, определяет наличие оси симметрии. Поворотные оси характеризуются числом N, значение которого определяет порядок оси.
По способу расположения узлов кристаллических решеток, обладающих трансляционной симметрией, различают 14 структур, которые называются решетками Браве. Количество ближайших атомов в решетке называется координационным числом
Для обозначения узлов пространственной решетки, кристаллографических направлений и плоскостей используются так называемые “индексы Миллера”.
Процедура их введения заключается в следующем. Вначале выбираются в качестве осей векторы элементарной ячейки (рис. 8) a, b, c с началом координат в каком-либо узле, затем определяются три отрезка, отсекаемые на осях и кратные периоду повторяемости вдоль каждой оси. Величины, обратные трем полученным числам, преобразуются в три целых числа той же пропорции. Полученные три числа (h, k, l) берутся в круглые скобки. В результате получают индексы Миллера для группы параллельных плоскостей.
7. Образование энергетических зон в кристаллах. Разрешенные и запрещенные зоны. Классификация кристаллов с точки зрения зонной теории
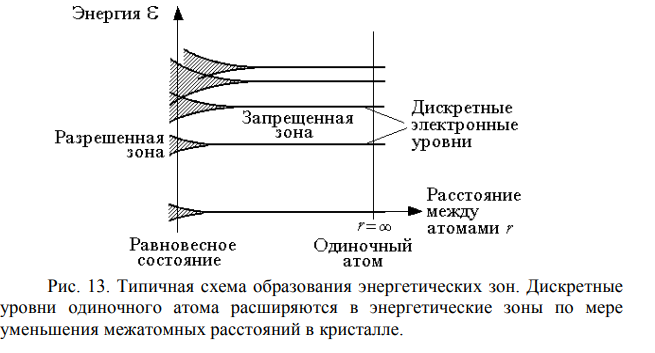
По мере сближения атомов сначала расщепляются самые высокие энергетические уровни, затем по мере сближения атомов – более низкие. При сближении атомов на расстояние а0 образуется устойчивая кристаллическая структура, которой соответствует энергетическая диаграмма, показанная в левой части рисунка.
Разрешенные зоны отделены друг от друга запрещенными зонами, в которых отсутствуют разрешенные уровни. Ширина разрешенных зон по мере перемещения вверх по энергетической шкале возрастает, а ширина запрещенных зон соответственно уменьшается.
С точки зрения зонной теории все твердые тела можно подразделить на две основные группы: материалы, у которых валентная зона перекрывается зоной проводимости, и материалы, у которых валентная зона и зона проводимости разделены запрещенной зоной. В первом случае незначительное внешнее энергетическое воздействие переводит электроны на более высокие энергетические уровни, что обуславливает хорошую электропроводность материалов. Во втором случае переходы на более высокие энергетические уровни связаны с необходимостью внешнего энергетического воздействия, превышающего ширину запрещенной зоны. Материалы, в энергетической диаграмме которых отсутствует запрещенная зона, относятся к проводникам, материалы с узкой запрещенной зоной (менее 3 эВ) – к полупроводникам, материалы с широкой запрещенной зоной (более 3 эВ) – к диэлектрикам
8. Физические свойства металлов и сплавов. Влияние свободных электронов на физические свойства (теплоемкость, электропроводность, блеск). Типы сплавов.
Металлами называются вещества, обладающие высокими электропроводностью, теплопроводностью, прочностью, а также характерным блеском.
Металлы по сравнению с диэлектриками более мягкие (пластичные), потому что один слой кристалла легко скользит над другим. Скольжение слоев возникает не сразу, а последовательно от атома к атому.
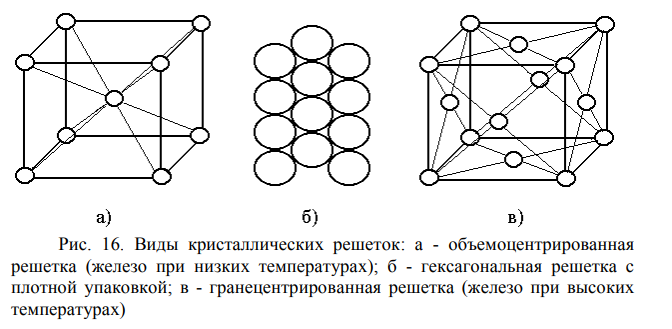
Свойства металлов обусловлены строением их кристаллической решетки. Большинство металлов имеют гранецентрированную, объёмно-центрированную кубическую или плотно упакованную гексагональную решетку

Свободные электроны в металле обладают квантовыми свойствами, главным из которых является то, что их энергия квантована, и они подчиняются принципу запрета Паули, согласно которому в состоянии с одной и той же энергией может находиться не более двух электронов с противоположно направленными спинами.
Принцип Паули позволяет объяснить распределение электронов по энергиям в твердом теле. Они располагаются по два электрона на каждом уровне, начиная с самого нижнего до самого высокого (рисунок 2.2, а). Уровень, который отделяет полностью заполненные энергетические уровни от полностью не заполненных при 0


