Файл: Контрольная работа по общей и неорганической химии Вариант 81 студент гр. ЗаУд122 Стрельцов А. Н.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 13
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования РФ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Владимирский государственный университет им. А.Г. и Н.Г. Столетовых»
Кафедра химии
Контрольная работа по общей и неорганической химии
Вариант № 81
Выполнил:
студент гр. ЗаУд-122
Стрельцов А.Н
Проверил:
Красильникова И.А.
Владимир 2023
20. а) Напишите электронную формулу атома сурьмы Sb. б) Распределите по квантовым ячейкам электроны двух последних уровней атома сурьмы, соблюдая принцип Паули и правило Гунда. в) Зная, что сурьма в соединениях может проявлять высшую валентность, равную V, определите, на каких подуровнях находятся валентные электроны атома сурьмы и укажите эти электроны. Напишите значения четырех квантовых чисел для всех валентных электронов атома сурьмы
Решение:
А)Sb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3
Короткая запись:
Sb: [Kr]5s2 4d10 5p3
Б)5s2 5p3
В) Количество валентных электронов в атоме сурьмы –
5.Орбиталь N L M S
| S | 5 | 0 | 0 | +1/2 |
| S | 5 | 0 | 0 | -1/2 |
| P | 5 | 1 | -1 | +1/2 |
| P | 5 | 1 | 0 | +1/2 |
| P | 5 | 1 | 1 | +1 |
27. а) Определите число связей в молекуле CH3COOH. б) Определите, какой тип гибридизации в молекуле BF3. 18 Изобразить геометрическую структуру данной молекулы. в) В какой из перечисленных молекул BeCl4, MgF2, CaBr2 , SrI2 связь элемент - галоген является наиболее полярной? Почему? г) В какой из приведенных молекул O2, N2, Cl2 имеется больше πсвязей? Ответ обоснуйте
Решение:
А)1-пи связь,7-сигма связей
Б)sp2-гибридизация валентных орбиталей бора в соединении BF3.
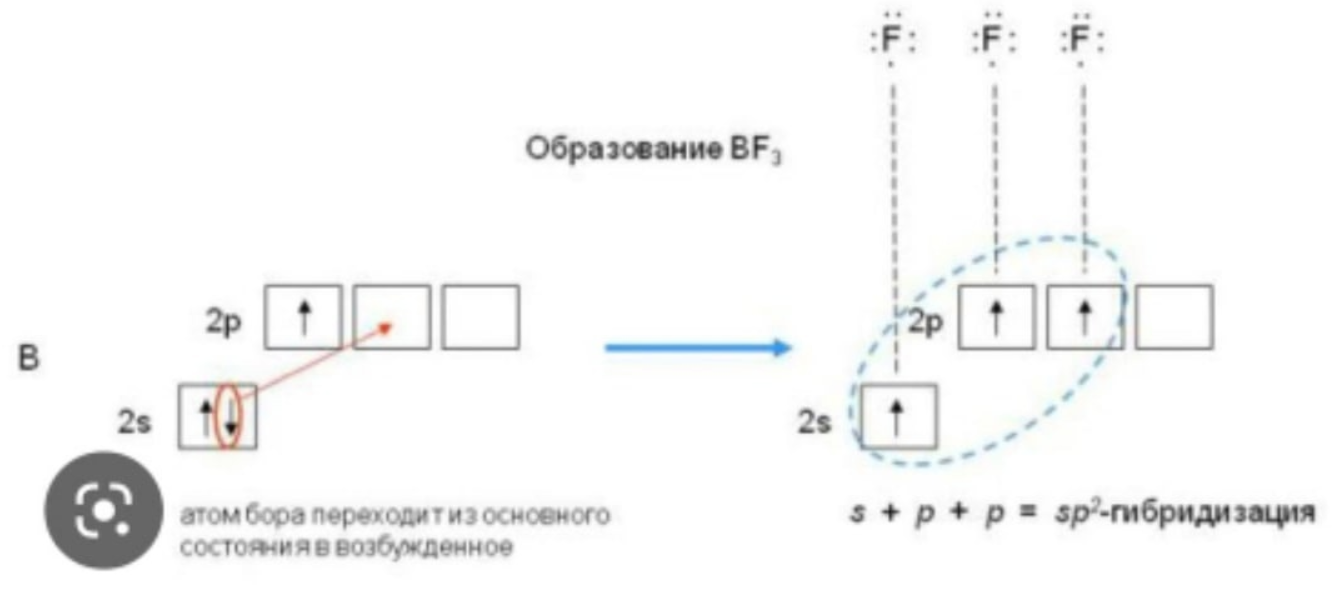
В)BeCl4
Г)В молекуле кислорода - двойная связь: O=O
одна из них - сигма -связь, другая - пи-связь
молекуле азота N2 связь тройная, можно сделать вывод, что присутствует одна сигма и две пи связи.
Сl3 Cl:Cl, Cl-Cl Между атомами одна сигма связь, молекула линейная
64. а) Сколько эквивалентов H2SO4 вступит в реакцию с 20 г Ca(OH)2? б) В каком количестве KOH содержится столько же эквивалентов, сколько в 60 г NaOH? в) После обработки нитратом серебра 0,986 г хлорида металла образовалось 1,732 г AgCl. Вычислите эквивалент металла.
А)49
Б) Молярная масса эквивалента КОН равна одной его молярной массы, т. е. 56,098 г/моль. Следовательно, в 60 г NaOH.
содержится 60/56,098 = 1,6 эквивалентов. Молярная масса эквивалента NaOH равна одной его молярной массе, т.е. 60/1 = 60г/моль. Отсюда 1,6 эквивалентов составляет 60. 1,6 = 96г.
В)-******************
94. а) Sb + HNO3 (конц.) = Sb2O5 +
б) Zn + KMnO4 + H2SO4 =
в) H2S + K2Cr2O7 + H2SO4 =
Решение:
а)2 Sb(0) + 10 HN(5)O3 → Sb2(5)O5 + 5 H2O + 10 N(4)O2
б) 5 Zn (s) + 2 KMn(7)O4 (aq) + 8 H2SO4 (aq) → 8 H2O (l) + K2SO4 (aq) + 2 Mn(2)SO4 (aq) + 5 Zn(2)SO4
в) 3 H2S(-2) + K2Cr2(6)O7 + 4 H2SO4 → 7 H2O + K2SO4 + Cr2(3)(SO4)3 + 3 S
110. a)
б) Вычислите массовый процент раствора, полученного растворением 25 г CuSO, в 1 л H..
в) Давление пара воды при 80°С равно 355 мм рт.ст. Вычислить понижение давления пара над раствором, содержащим 0,5 моля растворенного вещества в 50 моль воды.
Решение:
А)
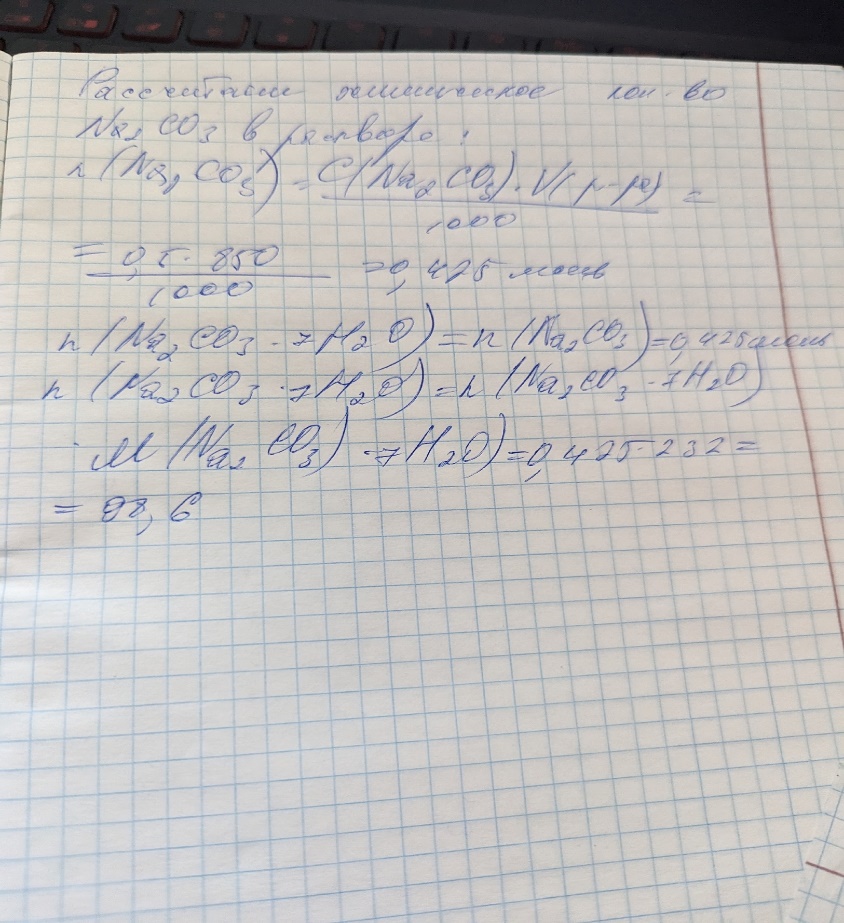
Б) CuSO4*5H2O -250 г/моль Х г CuSO4 -160 г/моль
Отсюда Х = 25*160/250 = 16 г m(р-ра) = m(CuSO4)/w = 16 г/0,08 = 200 г m(H2O) = m(р-ра) - m(CuSO4*5H2O) = 200 - 25 = 175 г
В)
(P°-P)/P° = N
N=0,5/(0,5+50)=0,0099 - мольная доля растворенного в-ва
(P°-P)=0,0099*355=3,5 мм рт. ст.
136. а) рН раствора соляной кислоты (НCl) равен 2,86. Сколько граммов соляной кислоты содержится в 1л этого раствора?
б) Вычислите рН 0,05 М раствора гидроксида аммония NH4OH, К= 1,8 ·10-5
Решение:
А)
Б) NH4OH ↔ NH4+ + OH-
С(H+) = Кв/С(ОН-) = 1,8*10^-5/0,2 = 9 * 10^-5
pH = -lgC(H+) = 4,046
Контрольные вопросы и задачи Вычислить ДН°, AG°, AS° приведенных ниже реакций. Сделать вывод о возможности протекания приведенных реакций в указанном направлении при 25°С, если реакция при комнатных условиях не идет, выяснить, пойдет ли реакция при других температурах.
176. 4HClr + O2r = 2H
2Or +2Cl2r

Вывод: Возможность протекания реакции определяется величиной изменения энергии Гиббса. При получаем: следовательно, реакция не протекает самопроизвольно в прямом направлении при Определим температуру, в которой система будет находиться в состоянии химического равновесия, для которого должно соблюдаться условие Таким образом, данная реакция может протекать самопроизвольно при температуре выше.
Контрольные вопросы и ответы.
В каждом задании равновесная система относится к пп. «а» и «б». Для п. «а» написать выражение константы равновесия и определить, в какую сторону сместится равновесие при повышении в заданной системе давления, температуры. Ответ обосновать. Какими ещё воздействиями на систему равновесие можно сместить вправо для п. «б» задание в каждом конкретном случае своё.
186. а) SO2 (г) + Cl2 ↔ SO2Cl2 (г).
б) Найдите равновесную концентрацию SO2Cl2, если константа равновесия равна 1,5; а исходные концентрации SO2, Cl2 и SO2Cl2 равны соответственно 2 моль/л, 1 моль/л, 0 моль/л
Решение:
A) В системе So2(газ)+CL2(газ) = (обратная реакция) SO2CL2(газ)+Q
В связи с принципом Ле Шателье - равновесие сместится вправо, в сторону уменьшения числа молекул
Увеличение концентрации любого из исходных веществ смещает химическое равновесие вправо.
Б)


215. Напишите в молекулярной и краткой ионной форме уравнения гидролиза солей. Если гидролиз идёт по стадиям. Напишите уравнения гидролиза по стадиям. Укажите условия, при которых происходит данная стадия гидролиза. Укажите, как изменяется pH-среды.
a) Fe2(SO4)3 б) K2S в) CH3COOAg
Решение:


270. На железное изделие нанесено пористое кадмиевое покрытие. Напишите уравнения реакций тех процессов, которые будут протекать на анодных и катодных участках при коррозии этого изделия в кислой, щелочной и нейтральной средах. Определите, в какой среде железное изделие будет более надёжно защищено от коррозии.
Решение:

300. Рассчитайте, сколько времени должен длиться электролиз, чтобы силой тока 5 А выделилось на катоде 50 г меди из 1 л 1 М водного раствора CuSO4.

