Файл: Контрольная работа по дисциплине "физическая химия" студент группы 9020 Масленкова Д. А. Проверил.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 33
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
РЯЗАНСКИЙ ГОСУДАРСТВЕННЫЙ РАДИОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ИМ. В.Ф. УТКИНА
Кафедра химической технологии
Контрольная работа по дисциплине
"ФИЗИЧЕСКАЯ ХИМИЯ"
Выполнил:
студент группы 9020
Масленкова Д. А.
Проверил:
Логинов В. С.
РЯЗАНЬ 2022
8 вариант
Контрольная работа 1- Гомогенный катализ
Задача 1. Кислотно-каталитическая реакция В Р протекает согласно механизму


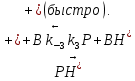
Определите зависимость наблюдаемой константы скорости реакции (kнабл) от кислотности среды h0, если скорость депротонизации вещества ВН+ больше, чем скорость его превращения в продукт. Рассчитайте значение kнабл.
| Дано: k1 = 310-4 k-1 = 310-2 k2 = 310-5 k3 = 2,510-3 h0 = 1,5 | Найти: kнабл. Решение: Выведем выражение, связывающее кислотность среды и наблюдаемую константу скорости каталитической реакции:    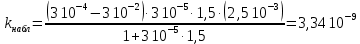 |
| | Ответ: 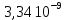 |
Задача 2. Гидролиз уксусного ангидрида (CH3CO)2O катализируется как гидроксил-анионом OH–:
(CH3CO)2O + OH– CH3COOH + CH3COO–, k1 M-1c-1,
так и ионом гидроксония H3O+:
(CH3CO)2O+H3O+→[(CH3CO)2H3O]+→ 2CH3COOH+H3O+.
Эффективная константа кислотного гидролиза равна kэф M-1
c-1. При каком рН водного раствора уксусный ангидрид будет наиболее устойчив?
| Дано: k1 = 22 kэф = 18 10-3 | Найти: При каком рН водного раствора уксусный ангидрид будет наиболее устойчив? Решение: Полная скорость гидролиза уксусного ангидрида является суммой скоростей по обоим каналам реакции. Как следует из размерности константы скорости M-1c-1 , эффективная скорость реакции по каналу 2 зависит от концентраций (CH3CO)2O и H3O+, в то время как концентрация воды H2O уже учтена в константе: 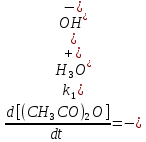 Минимум скорости гидролиза, как легко видеть, соответствует минимуму выражения: Минимум скорости гидролиза, как легко видеть, соответствует минимуму выражения: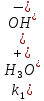 Продифференцируем его по Продифференцируем его по  , учитывая, что , учитывая, что 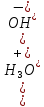 : :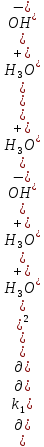 Отсюда:  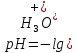 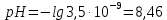 |
| | Ответ: 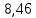 |
Задача 3. Каталитическая реакция идёт по схеме

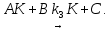
В двух опытах при следующих начальных концентрациях реагентов были получены приведённые в таблице значения времён превращения А на 50 % и
75 %.
Найдите константы скорости k1, k2, k3. Концентрацию AK считать стационарной
| [K]0 моль/л | [A]0 моль/л | [B]0 моль/л | 50 (1) %, ч | 75 (1) %, ч | |
| 10–6 | 0,1 | 0,2 | 50 (1) % | 75 (1) % | |
| 10–6 | 0,1 | 0,3 | 50 (2) % | | |
| Дано: 50 (1) = 6,5 % 75 (1) = 10,2 % 50 (2) = 4,7 % | Найти: Найдите константы скорости k1, k2, k3. Решение: Запишем выражение для вычисления константы скорости для реакций второго порядка: 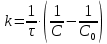 Запишем выражения для определения концентрацию АК:  Запишем выражение для определения концентрации реакции второго порядка: 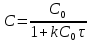 Отсюда  | ||||
| | Ответ: 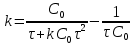 | ||||
Задача 4. (4.2.2.). Каталитическая реакция S1 + S2 →P1 + P2 протекает в присутствии слабой кислоты НА по механизму:
1)

2)
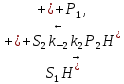
3)
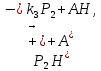
4)
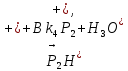
5)
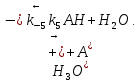
Известно, что реакция лимитируется стадиями депротонирования продукта реакции, а стадии (1), (2) и (5) являются быстрыми и равновесными.
Каким общим или специфическим является катализ данной реакции кислотой HA, если:
а) стадия (3) протекает значительно быстрее, чем стадия (4);
б) стадия (4) протекает значительно быстрее, чем стадия (3).
Ответ обоснуйте для обоих случаев.
Решение:
а) В данном случае, катализ будет специфическим основным, т.к. катализатором являются основания Аррениуса и лимитирующей стадией является вторая стадия распада S-.
б) В данном случае, катализ будет специфическим кислотным, т.к. катализатором является кислоты Аррениуса и лимитирующей стадией является вторая стадия распада SH+.
Контрольная работа 2 – Ферментативный катализ
Часть 1
Задача 1. Получите кинетическое уравнение для процесса ферментативного катализа, в котором участвуют два промежуточных компонента:
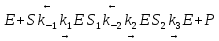
Решение:
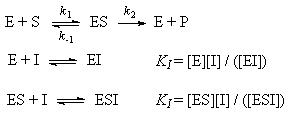
Задача 2. Каталитический процесс S P осуществляется по механизму:
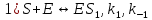
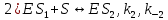
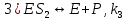
Определите скорость реакции в начальный момент времени (r0) при концентрации субстрата и фермента [S]0
и [E]0.
| Дано: 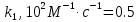 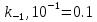 k2/k-2 = 5 k-2 = 0.5 k3, c-1 = 0.1 [S0], моль/л = 0,05 [Е0], 10-6 моль/л = 0,5 | Решение: Вычислим скорость реакции в начальный момент времени по формуле: 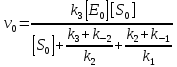 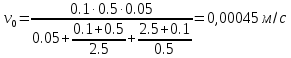 |
| Найти: Определите скорость реакции в начальный момент времени (r0) при концентрации субстрата и фермента [S]0 и [E]0. | Ответ: 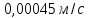 |
Задача 3. Реакция выделения водорода из воды под воздействием сильного восстановителя катионрадикала метилвиологена (S) катализируется ферментом гидрогеназой по схеме:
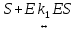
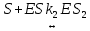
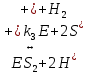
Напишите выражение для скорости выделения водорода и рассчитайте значение, найдите порядок реакции по S, E и Н+ при условии, что K1=K2, M-1, pHисх; [Е]0 мол-л*см–3; [S]0 М. Оцените константу k3, зная, что из 100 мл раствора за час выделилось V мл H2 (P = 760 мм рт. ст.).
| Дано: k1 = k2 = 0,01 pHисх = 1 [Е]0 = 6,021017 [S]0 = 1.8 V = 0.2 | Решение: Запишем выражение для скорости выделения водорода:  При достаточно малых концентрациях субстрата, когда [S] Км, можно принять, что Км + [S] ≈ Км и поэтому реакция имеет первый порядок по отношению к субстрату и является линейной функцией концентрации субстрата. Рассчитаем константу k3 по формуле: 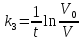 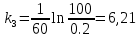 Вычислим значение скорости: 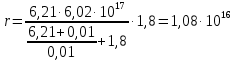 |
| Найти: Напишите выражение для скорости выделения водорода и рассчитайте значение, найдите порядок реакции по S, E и Н+. | Ответ: 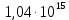 |
Часть II.
1. При добавлении ингибитора в ферментативную систему, подчиняющуюся схеме Михаэлиса–Ментен, максимальная скорость реакции уменьшилась в x раз, а КМ не изменилась. Предложите схему ингибирования и рассчитайте К1, если концентрация ингибитора равнялась C моль⋅л-1.
| Дано: x = 2 C = 0.510-5 | Решение: Так как максимальная скорость реакции уменьшилась, а КМ не изменилась, следовательно, для данной ферментативной системы характерно неконкурентное ингибирование. Запишем формулу для вычисления константы неустойчивости и рассчитаем ее: 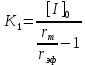 где 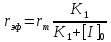 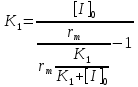 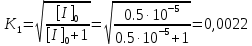 |
| Найти: 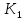 | Ответ: 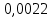 |
2. Определить тип ингибирования, константу Михаэлиса, константу диссоциации комплекса фермент – ингибитор и величину предельной скорости в реакции окисления N-метилглутамата, катализируемой N─метилглутаматдегидрогеназой в присутствии ингибитора α-кетоглутарата по следующим данным: [I]0 = 0 и [I]0 = 3 ммоль⋅л-1.
| Дано: [S]0 = 0,510-4 мольл r0 = 1,33 мкмольл-1 мин-1 [S]0 = 1,010-4 мольл r1 = 0,77 мкмольл-1 мин-1 | Решение: Так как концентрация фермента значительно больше концентрации субстрата, что соответствует конкурентному типу ингибирования. Вычислим константу диссоциации фермент–ингибиторного комплекса по формуле: 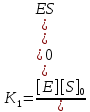 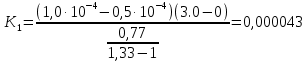 |
| Найти: | Ответ: 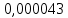 |


