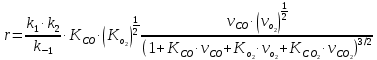Файл: Контрольная работа по дисциплине "физическая химия" студент группы 9020 Масленкова Д. А. Проверил.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 34
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
3. Пара─нитроанилид N─бензоил─N─аргинина является одновременно и субстратом и ингибитором гидролиза, катализируемого протеалитическим ферментом бактериального происхождения. При избыточных концентрациях субстрата образуется неактивный комплекс фермента с двумя молекулами субстрата ES2. Используя экспериментальные данные, определите значения КМ, kкат и KS2.
| Дано: [S]0 = 60,0 мкмольл [r/Е]0 = 6,63 c-1 [S]0 = 2 мкмольл [r/Е]0 = 4,22 c-1 | Решение: Построим график зависимости 1/[r/Е]0 и 1/[S]0: 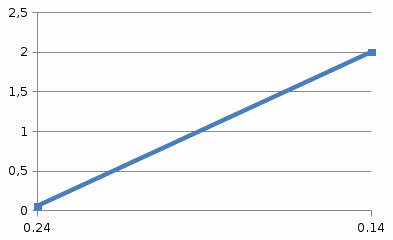 Из графика следует, что КM = 19,5 и kкат = 1 |
| | Ответ: КM = 19,5 и kкат = 1 |
Контрольная работа 3 – Гетерогенный катализ
Задача 1. Вычислите площадь поверхности катализатора, 1 г которого при образовании монослоя адсорбирует V см3 газа А (при 1,01*105 Па и 273 К). Адсорбция измеряется при T К, эффективная площадь, занятая молекулой газа А равна S0.
| Дано: A = Кr V = 344 см3 Т = 77,5 К S0 = 0,195 нм2 | Решение: Вычислим площадь поверхности катализатора по формуле:   |
| Найти: Вычислите площадь поверхности катализатора | Ответ: 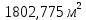 |
Задача 2. Рассчитайте удельную поверхность катализатора, если адсорбция криптона при 77,5 К характеризуется следующими данными:
| P, мм. рт. ст. | 0,447 | 0,645 | 0,159 | 0,450 |
| Объем адсорбированного газа 1г катализатора, см3/г | 0,4185 | 0,4619 | 0,5234 | 0,6313 |
Масса катализатора 13,03 г. Площадь, занимаемая одной молекулой криптона, S
0 = 19,2*10-20 м2, плотность криптона dо°с = = 3,739 г/л, давление насыщенного пара криптона Рs — 2,57 мм рт. ст. = 342,65 Па.
Решение:
Согласно уравнению изотермы адсорбции БЭТ, прямолинейная зависимость получается в координатах
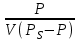
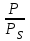 .
. 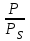 | 0,0385 | 0,0700 | 0,1430 | 0,2200 | 0,2660 |
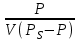 | 3,16 | 5,02 | 9,50 | 14,93 | 18,33 |
На основании полученных данных строим график. Из графика находим тангенс угла наклона прямой:

tg =
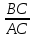 =
=  . (а)
. (а)Отрезок, отсекаемый на оси ординат, равен
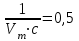 . (б)
. (б)Решая совместно уравнения (а) и (б), получаем значения с = 134,4 и
Vm = 0,0149 см3/г.
Для пересчета Vm на Г воспользуемся формулой:
Г =
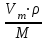 =
= 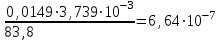 моль/г.
моль/г.Удельную поверхность катализатора рассчитывают по уравнению:
Sуд = ГNAS0 = 6,64 107 6,02 102319,2 1020 = 0,078 м2
Задача 3. При 77,5 К на платиновом катализаторе была снята изотерма адсорбции криптона. Получены данные:
| P, мм. рт. ст. | 0,149 | 0,200 | 0,308 | 0,491 |
| Объем адсорбированного газа 1г катализатора, см3/г | 0,2763 | 0,3040 | 0,3524 | 0,4098 |
Рассчитайте постоянные в уравнении БЭТ и удельную поверхность катализатора
, если площадь, занимаемая одной молекулой криптона, SKr = 19,2*10-20 м2, плотность криптона dо°с = 3,739 г/л, давление насыщенного пара криптона Рs — 2,57 мм рт. ст. = 342,65 Па.
Решение:
Согласно уравнению изотермы адсорбции БЭТ, прямолинейная зависимость получается в координатах
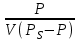
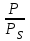 .
. 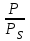 | 0,0385 | 0,0700 | 0,1430 | 0,2200 | 0,2660 |
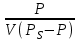 | 3,16 | 5,02 | 9,50 | 14,93 | 18,33 |
На основании полученных данных строим график. Из графика находим тангенс угла наклона прямой:

tg =
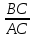 =
=  . (а)
. (а)Отрезок, отсекаемый на оси ординат, равен
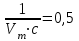 . (б)
. (б)Решая совместно уравнения (а) и (б), получаем значения с = 134,4 и
Vm = 0,0149 см3/г.
Для пересчета Vm на Г воспользуемся формулой:
Г =
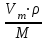 =
= 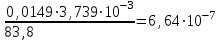 моль/г.
моль/г.Удельную поверхность катализатора рассчитывают по уравнению:
Sуд = ГNAS0 = 6,62 107 6,02 102319,2 1020 = 0,075 м2
задача 4. Каталитическое окисление CO на однородной поверхности Pd протекает следующим образом:
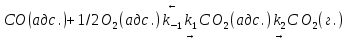
Равновесие на поверхности устанавливается быстро. Вторая стадия – медленная. Используя уравнение Ленгмюра для многокомпонентной адсорбции (23.22), выведите формулу для зависимости скорости реакции образования газообразного CO2 от парциальных давлений всех участников реакции.
Решение:
Скорость реакции образования газообразного CO2 равна скорости самой медленной, последней ее стадии:

На первой стадии – обратимого окисления CO – скорость прямой реакции равна скорости обратной:
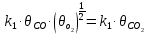
Отсюда можно найти долю центров, занятых CO2, и подставить в уравнение (1):

Осталось выразить доли занятых центров через парциальные давления. В случае смеси газов доля адсорбционных центров, занятых молекулами i-го газа, описывается модифицированным уравнением Лэнгмюра:

(суммирование в знаменателе проводится по всем газам, находящимся в смеси).
Записав соответствующие уравнения для CO и O2 и подставив их в формулу (2), находим зависимость скорости реакции от парциальных давлений всех участников реакции (в том числе и CO2):
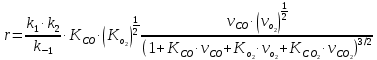
Ответ: