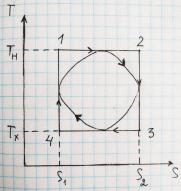Файл: Лабораторная работа 113 цикл карно ст гр. Угф1901 Абдурахмонов М. Принял Хашаев М. М.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.04.2024
Просмотров: 11
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лабораторная работа № 113
ЦИКЛ КАРНО.
Выполнил: ст. гр. УГФ-19-01 Абдурахмонов М.
Принял: Хашаев М. М.
Цель работы: изучить на компьютерной модели цикла Карно для идеального газа.
Задание:
-
ознакомиться с компьютерной моделью, иллюстрирующей цикл Карно для идеального газа. -
определить по данным, полученным на основе компьютерной модели цикла Карно:
-
работу, совершённую газом за цикл; -
приведенное количество тепла; -
коэффициент полезного действия цикла Карно.
-
рассмотреть цикл Карно с точки зрения изменения энтропии.
Описание установки:
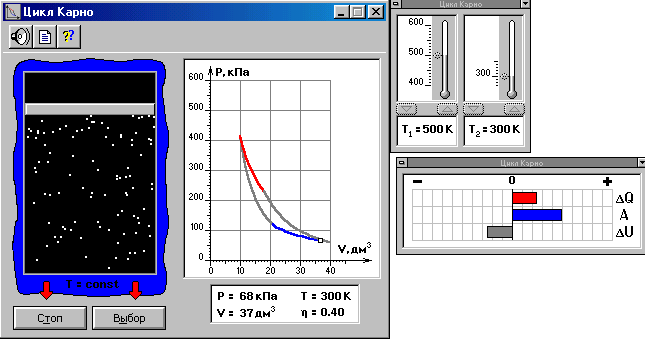 Рис.1. Компьютерная модель цикла Карно для идеального газа.
Рис.1. Компьютерная модель цикла Карно для идеального газа.Установкой в данной лабораторной работе является компьютерная модель, иллюстрирующая цикл Карно для идеального газа. Как видно из рис.1 данная установка представляет собой регулятор термометров, цикл Карно в системе координат P-V, а также значения термодинамических параметров и коэффициента вязкости в момент остановки процесса.
Методика выполнения работы:
 1
12. Нажимаем кнопку «СТАРТ» и наблюдаем перемещение точки по замкнутой кривой цикла Карно.
3. Затем, нажав кнопку «СТОП», останавливаем процесс вблизи точки 2, которая соответствует переходу изотермического расширения газа в адиабатическое. Записываем в таблицу 2 значения V2 и p2, которые в момент остановки процесса в точке 2 будут обозначены в нижнем прямоугольнике окна опыта.
4. Аналогичные измерения проводим для состояний 3, 4 и 1 и записываем значения давлений и объёмов газа в соответствующие столбцы таблицы 2.
5. Повторяем измерения еще два раза. Данные записываем в строки 2 и 3 таблицы 2.
6. Повторяем весь цикл измерений ещё два раза. Результаты опытов заносим в таблицы 3 и 4, аналогичные таблице 2.
Обработка результатов измерений:
1. Для каждого из вариантов температур Т1, Т2 находим средние значения давлений (р1, р2, р3 и р4) и объемов (V1, V2, V3 и V4). Результаты записываем в таблицы 2,3,4.
2. Используя полученные средние значения давлений и объемов, находим
3. С помощью уравнения состояния идеального газа определяем число молей газа в данной компьютерной модели. Оцениваем погрешность .
4. Рассчитываем Q1, Q2, A и записываем полученные значения в таблицу 5.
5. По формуле
 рассчитываем и записываем в таблицу 5 коэффициенты полезного действия цикла Карно для всех рассмотренных случаев.
рассчитываем и записываем в таблицу 5 коэффициенты полезного действия цикла Карно для всех рассмотренных случаев. 6. Вычисляем приведенное количество тепла для всех процессов. Результаты записываем в таблицу 5.
7. Находим изменение энтропии для всех рассмотренных процессов.
8. Проанализировав полученные результаты, делаем выводы.
Ответы на контрольные вопросы:
1. В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева): pV = νRT =(m/M)RT
2. Внутренняя энергия макросистемы – это функция состояния системы, т.е. она не зависит от предыстории системы и состоит из: суммарной кинетической энергии хаотического движения молекул; потенциальной энергии взаимодействия всех молекул системы; внутренней энергии частиц, составляющих систему.
Внутренняя энергия идеального газа
равна произведению средней энергии молекул газа < > к их числу N = NA, где число молей, NA число Авогадро (NA = 6.021023моль-1): U = N < >
3. Первое начало термодинамики: количество теплоты, сообщенное системе, идет на приращение ее внутренней энергии и на совершение системой работы над внешними телами.
4. Второе начало термодинамики (закон возрастания энтропии замкнутой системы при необратимых процессах): любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
5. Первое начало термодинамики для изотермического процесса: δQ = δA
Q = A12=(m/M)RTln(V2/V1) = (m/M)RTln(p1/p2)
Первое начало термодинамики для адиабатического процесса: δA = -dU
pdV = -(m/M)CVdT
6. Тепловые двигатели – это периодически действующие двигатели, совершающие работу за счет получаемого извне количества теплоты.
Основные элементы теплового двигателя: нагреватель, холодильник и рабочее тело.
7. Холодильник поглощает часть энергии рабочего тела, он нужен для того, чтобы работа, совершаемая телом за один цикл, была положительной. В двигателе внутреннего сгорания роль холодильника играет атмосфера.
8. Обратимые и необратимые процессы отличаются тем, что обратимый процесс допускает возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения, а необратимый процесс не допускает такой возможности.
Все реальные процессы необратимы, потому что они протекают с конечной скоростью и сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды.
9. Энтропия – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы.
Размерность энтропии равна Дж∙моль-1∙K-1.
10. Энтропия замкнутой системы может либо возрастать (для необратимых процессов), либо оставаться постоянной (для обратимых процессов).
Энтропия не замкнутой системы может вести себя любым образом.
11. Вероятностное определение энтропии: энтропия при абсолютном нуле температуры равна нулю.
12. Первая теорема Карно: коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур Т1 и Т2 нагревателя и холодильника, но не зависит от устройства машины, а также от вида используемого рабочего тела.
Вторая теорема Карно: КПД всякой тепловой машины не может превосходить КПД идеальной тепловой машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника.
13. Вывод формулы для коэффициента полезного действия цикла Карно:
Qн=Tн (S2 – S1); Qх=Tх (S2 – S1)
η = 1 -
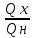 = 1 -
= 1 - 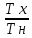
14. Пути повышения КПД тепловых двигателей: уменьшение потерь на трение сопрягающихся деталей, увеличение качества топлива и его сгорания, совершенствование систем отвода сгораемых газов.
15. Изотермический и адиабатический процессы и цикл Карно в системе координат T-S.