Файл: 74. Как изменяются скорость химической реакции и концентрации реагирующих веществ во времени Приведите графические зависимости.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.04.2024
Просмотров: 8
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Контрольная работа
Вариант 4
Студента ХТБз-20-1
Николаенко Анастасии Владимировны
74. Как изменяются скорость химической реакции и концентрации реагирующих веществ во времени? Приведите графические зависимости.
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
С
 корость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
корость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:В
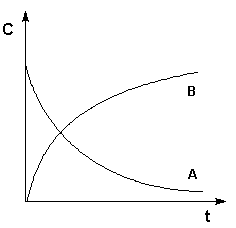
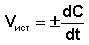 различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции.
Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции представляет собой общий порядок реакции.
Зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
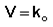 Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид: Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ
Р
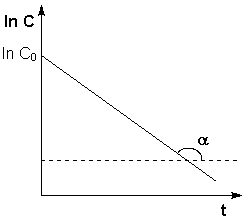
Зависимость логарифма концентрации от времени для реакций первого порядка.
Д
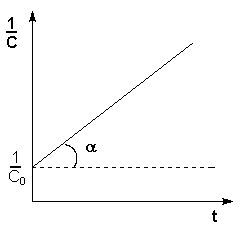
Зависимость обратной концентрации от времени для реакций второго порядка
84. Охарактеризуйте группу дифференциальных методов определения порядков реакции.
Кинетическое уравнение, выражает скорость реакции по веществу А при избыточных концентрациях всех остальных реагентов:
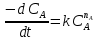 или ω =
или ω = 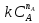
Прологарифмируем это уравнение при двух значениях времени реакции:
lnω1 = lnk + nA∙lnCA1 (1)
lnω2 = lnk + nA∙lnCA2 (2)
Вычтем из 2 уравнение 1 и выразим nA:
nA =

По графику зависимости С от t находим при двух значениях t скорости реакции. Скорость реакции есть угловой коэффициент зависимости при данном t: ω1 = dC1/dt1 и ω2 = dC2/dt2.

Вторая разновидность дифференциального метода основана на построении начальных участков экспериментальных кинетических кривых для реакции, проведенной при ряде различных начальных концентраций реагента
 . Остальные реагенты берут в большом избытке
. Остальные реагенты берут в большом избытке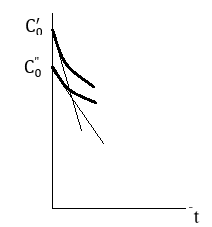
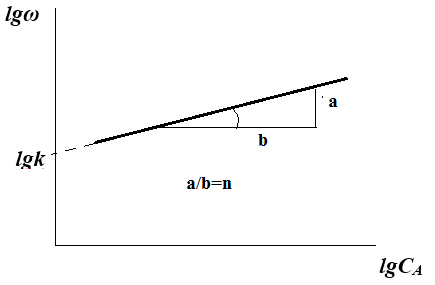
Третья разновидность дифференциального метода основана на построении графика в координатах lgw от lg C:
lgω = lgk + nA∙lgCA
Определив скорость реакции при нескольких значениях t, строят график lgw от lg C
94. Основные положения теории активированного комплекса. Поверхность потенциальной энергии. Статистический и термодинамический аспекты ТАК при расчете константы равновесия.
Элементарный акт химического превращения состоит в постепенной перестройке химических связей. При этом связи между атомами в исходных молекулах постепенно разрываются, расстояния между атомами возрастают и зарождаются новые связи, приводящие к образованию новых молекул, являющихся продуктами реакции.
В ходе образования новой молекулы любой элементарный акт проходит некоторое переходное состояние, при котором уже возникают новые связи, но еще не совсем утрачены исходные. При этом образуется так называемый активированный комплекс, в состав которого входят как атомы исходного вещества, так и будущей конечной молекулы.
По оси ординат откладывают потенциальную энергию частиц, по оси абсцисс – любой параметр, меняющийся синхронно с изменением уровня энергии частиц в ходе реакции, например, межатомное расстояние в исходной молекуле А-В. Назовем эту ось просто «координатой реакции». Тогда изменение потенциальной энергии вдоль координаты реакции будет иметь вид
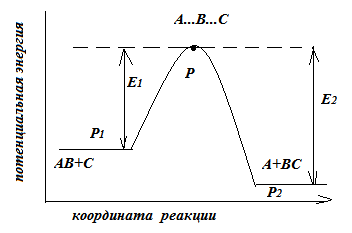
Для разрыва связи А-В требуется энергия. Поэтому вдоль пути реакции энергия системы из трех атомов (А, В, С) возрастает.
Согласно молекулярно-кинетической теории, средняя скорость поступательного движения активированного комплекса вдоль пути реакции υ* (или иначе - средняя скорость прохождения активированным комплексом
вершины потенциального барьера Р) равна :
υ*
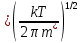
где m* - масса активированного комплекса.
Среднее время жизни активированного комплекса τ:
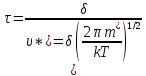
Число активированных комплексов, возникающих за время τ (или, иначе – число элементарных актов реакции) представляет собой концентрацию активных комплексов Сак в интервале
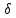
.
Тогда скорость реакции ω можно выразить как число элементарных актов в единице объема в единицу времени, или, иначе, как число активированных комплексов, пересекающих вершину потенциального барьера вдоль координаты реакции в единицу времени в единице объема:
ω =
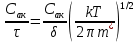
Недостатком теории является отсутствие экспериментальных данных о строении активированных комплексов большинства химических реакций. В этом случае приходится пользоваться предполагаемыми, наиболее вероятными структурами.


