ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.05.2024
Просмотров: 17
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ХИМИИ
1. Закон постоянства состава вещества.
любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причём отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это дает нам право вычислить массовое соотношение элементов в составе данного вещества
2Ar(H) : Ar(O) = 2*1 : 16 = 1 : 8
2. Квантово-механическая модель атома.
В
 квантово-механическая модель атома предполагает, что оно образовано центральным ядром, состоящим из протонов и нейтронов. Отрицательно заряженные электроны окружают ядро в диффузных областях, известных как орбитали.
квантово-механическая модель атома предполагает, что оно образовано центральным ядром, состоящим из протонов и нейтронов. Отрицательно заряженные электроны окружают ядро в диффузных областях, известных как орбитали.

n=1; 2; 3…..
n – главное кв. число

 l – орбитальное кв. число; l = 0, 1, 2, 3…(n-1)
l – орбитальное кв. число; l = 0, 1, 2, 3…(n-1) s p d f
s p d fm – магнитное кв. число; m = -l
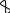 ms – спиновое кв. число
ms – спиновое кв. число3. Характеристики и свойства элементов в зависимости от положения в периодической системе элементов.
4. Энергия ионизации, сродство к электрону, электроотрицательность: дать определение, примеры.
Энергия ионизации – это энергия, которая нужна, что бы оторвать электрон от атома и удалить его на бесконечное расстояние. Легче всего оторвать от металла. Причем больше радиус металла тем дальше находится электрон и тем проще его оторвать. По периоду увеличивается, а по группе уменьшается.
СРОДСТВО́ К ЭЛЕКТРО́НУ, способность некоторых нейтральных атомов, молекул и свободных радикалов образовывать прочную связь с электроном, т. е. отрицательный ион.
Эле́ктроотрица́тельность
(χ) — свойство атома, характеристика способности атома в молекуле смещать к себе общие электронные пары
Слева направо увеличивается, сверху вниз уменьшается
5. Атомные и ионные радиусы, степень окисления дать определение, примеры.
Атомный, ионный радиус (или радиуса иона) равен минимальному расстоянию, на которое центр сферы данного атома (иона) может приблизиться к поверхности сфер соседних атомов (ионов). При движении сверху вниз атомный радиус растет. Слева на права радиус уменьшается.
Степенью окисления — количество электронов которые атом отдал или принял.
6. Количество вещества (моль), закон Авогадро. Следствия из закона Авогадро.
Для определения числа структурных частиц вещества в химии применяют особую величину – количество вещества n; n=N/Na; n=V/Vm; n=m/M.
Единицей количества вещества является моль. 1 моль любого вещества содержит 6,02·10^23 частиц. Это число называют числом Авогадро. Постоянная Авогадро: Nа = 6,02·10^23 1/моль.
7. Химическая связь и строение молекул: Ковалентная связь. Способы образования ковалентной связи.
К
H
H
H - H
овалентная полярная и неполярная связи
Н



 еполярная – связь между одинаковыми не металлами (H2);
еполярная – связь между одинаковыми не металлами (H2); О


О


О




О













 + Т.е делят электроны пополам
+ Т.е делят электроны пополам 


H
Cl


H
Cl








П




 олярная – два разных неметалла (HСl) + =
олярная – два разных неметалла (HСl) + =

Cl перетягивает электрон, и засечет этого становится отрицательно заряжен.
8
Na

Cl







Na
Cl








 . Химическая связь и строение молекул: Ионная связь, механизм образования.
. Химическая связь и строение молекул: Ионная связь, механизм образования. И
 онная связь – металл и неметалл и (NaCl); + =
онная связь – металл и неметалл и (NaCl); + = Cl забрал себе все и стал отрицательным, но засечет того что Na стал положительным после потери электрона они тянутся друг к другу.
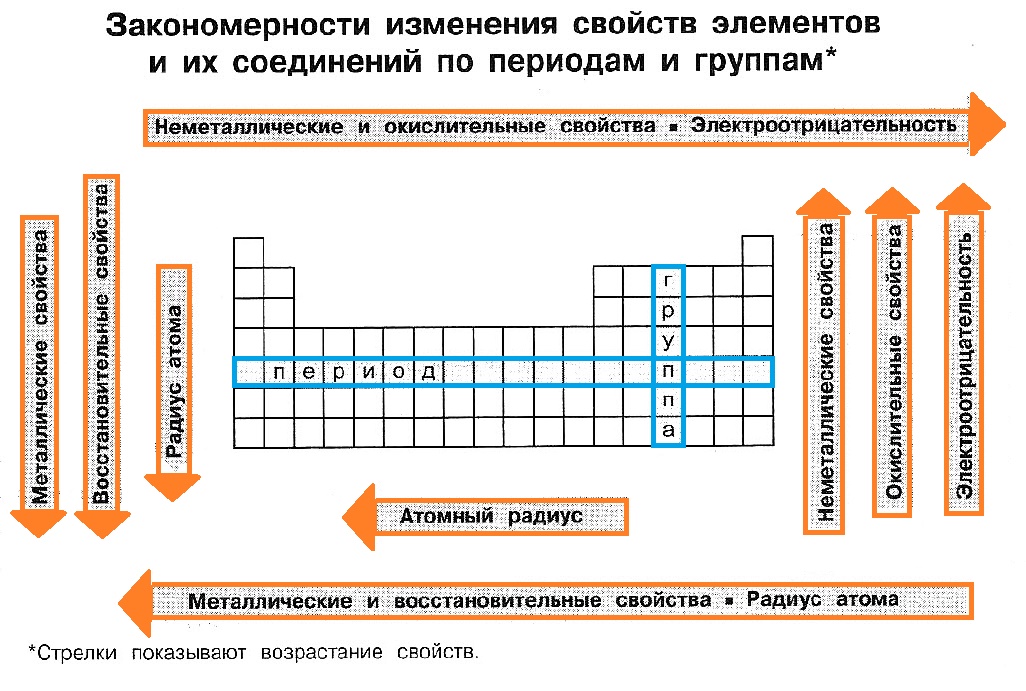
9. Химическая связь и строение молекул: Водородная связь. Донорно-акцепторная связь.
Водородная связь (Н-связь) – это связь, образуемая протонированным атомом водорода с сильноэлектроотцательным атомом той же или другой молекулы. Н2О
Донорно-акцепторный механизм
механизм, при котором один атом предоставляет в общее пользование два электрона, а другой принимает эти электроны на свою свободную орбиталь. Атом, предоставляющий электронную пару, называется донором, а атом, принимающий на свободную орбиталь электроны — акцептором.
10. Реакции ионного обмена.
Реакция ионного обмена — один из видов химических реакций, протекающих в полярных растворителях между ионами исходных компонентов (обязательно должен образоваться газ осадок(табл. растворимости) или вода)
HNO3 + NaOH = NaNO3 + H2O (вода)
Na2SO4 + BaCl2 = BaSO4 + 2NaCl (осадок)
11. Окислительно-восстановительные реакции.
0 0 -3 -2
(ОВР) - реакции, которые протекают с изменением степеней окисления атомов.
A
+3
l + O2 = Al2O3
A
-2
12
l -3e – Al 3 4 - восстановитель
O2 + 2*2e – 2O 4 3 - окислитель
12. Металлы, основные свойства, положение в периодической таблице элементов Д.И. Менделеева, строение электронной оболочки.
Металлы - химические элементы, атомы которых легко отдают электроны внешнего электронного слоя, превращаясь в положительные ионы.
К физическим свойствам относятся: цвет, плотность, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании и фазовых превращениях;
к химическим - окисляемость, растворимость, коррозионная стойкость, жароупорность;
Отдавая электроны внешнего уровня, атомы металлов образуют устойчивую оболочку ближайшего благородного газа и приобретают положительную степень окисления
13. Неметаллы, основные свойства, положение в периодической таблице элементов Д.И. Менделеева, строение электронной оболочки.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
14. Щелочные и щелочноземельные металлы, химические свойства, применение.
В свободном состоянии – типичные Ме, в среде имеют серебристый металлический блеск, у Cs – золотистый срез. На воздухе быстро тускнеют (исключения: Be и Mg), они сохраняют металлический блеск, т.к. покрываются защитной оксидной плёнкой.
Химические свойства: Атомы s-элементов могут только отдавать электроны. Энергия сродства к электрону равна 0.
Щелочноземельные Ме сгорают в кислороде, образуя оксиды, при дальнейшем окисление могут получены пероксиды.
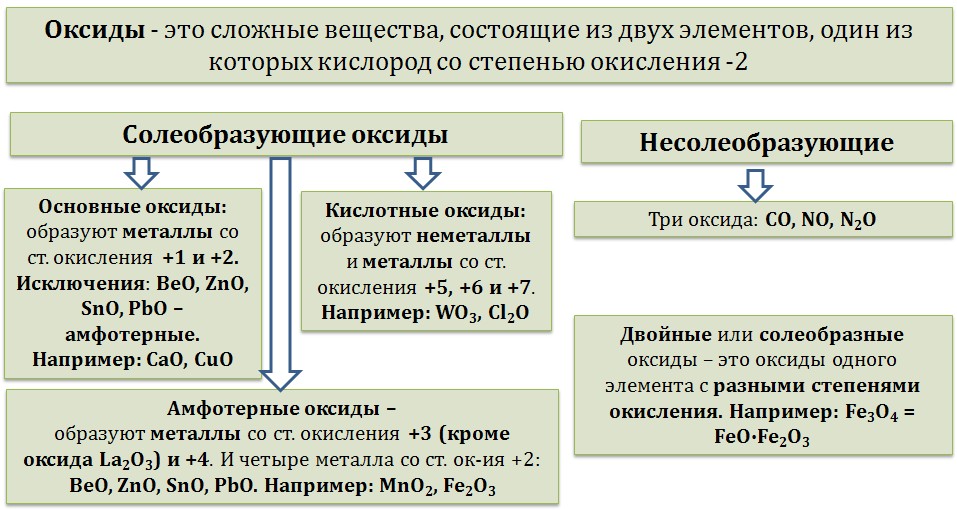
15. Оксиды, гидроксиды, получение, химические свойства, применение.
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
Получение:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
1.2. Окисление простых веществ-неметаллов. Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
