ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.05.2024
Просмотров: 18
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д. При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Химические свойства оксидов. Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.

16. Соли. Образование солей. Кислые, средние и основные соли, химические свойства, применение.
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
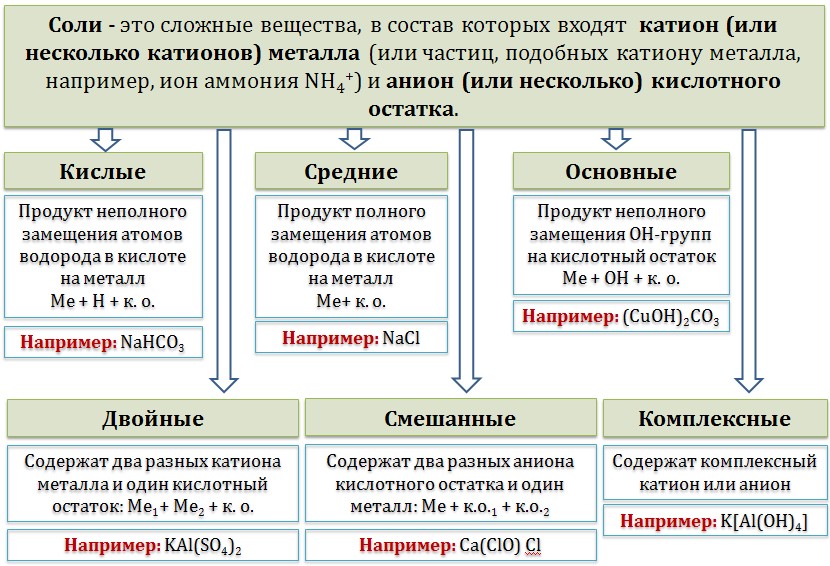
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
7. Некоторые соли при нагревании разлагаются. Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией.
8. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
9. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления

17. Направленность тепловых эффектов химических реакций. Экзотермический и эндотермический процессы.
Тепловой эффект химической реакции — это количество теплоты, которое поглощается или выделяется в результате протекания химической реакции.
Q — обозначение теплового эффекта химической реакции.
Единица измерения — килоджоули (кДж) или джоули (Дж).
1 кДж = 1 000 Дж.
Экзотермические реакции
реакции, протекающие с выделением теплоты (Q > 0) выделение энергии
эндотермические наоборот
реакции, протекающие с выделением теплоты (Q < 0) поглощение энергии
18. Теплота образования простых веществ. Энтальпия.
Теплота образования (Q обр)– это теплота, которая выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ при стандартных условиях. Теплоты образования простых веществ приняты равными нулю. Стандартные условия– давление 1 атм (101,3 кПа), Т= 298К (25 °С).
Энтальпи́я — функция состояния. термодинамической системы, определяемая как сумма внутренней энергии. и произведения давления. на объём.
19. Закон Гесса о сохранении и превращении энергии. Следствие из закона Гесса.
Закон Гесса
тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т. е. от числа и характера промежуточных стадий.
Следствие из закона Гесса
тепловой эффект реакции равен разности сумм теплот образования конечных и начальных участников реакций с учётом их стехиометрических коэффициентов:
20. Понятие об энтропии. Изменение энергии Гиббса - как движущая сила химических реакций.
Энтропия — функция состояния каждого вещества. Энтропия веществ меняется, когда происходит химическая реакция. Это изменение энтропии веществ (ΔS) называется "энтропия реакции" или "изменение энтропии в процессе".
Энергия Гиббса. Направленность химических процессов. Процессы, для протекания которых не нужен посторонний источник энергии, называются самопроизвольными.
Существуют две движущие силы процессов: стремление перейти в состояние с наименьшей энергией и выделить тепло и стремление перейти в наиболее вероятное состояние, с максимальной энтропией.
21. Направленность протекания химических реакций в зависимости от знаков ∆H, ∆S.
| Знак изменения функции | Возможность (невозможность) самопроизвольного протекания реакций | ||
| Н | S | | |
| - | + | | Возможно при любых температурах. |
| + | - | | Невозможно при любых температурах. |
| - | - | | Возможно при достаточно низких температурах. |
| + | + | | Возможно при достаточно высоких температурах. |
22. Общая характеристика растворов. Растворимость.
Растворы – это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Растворимость-это свойство твердого, жидкого или газообразного химического вещества, называемого растворенным веществом, растворяться в твердом, жидком или газообразном растворителе
23. Способы выражения концентрации растворов.
1.Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
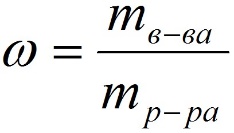
2.Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

3.Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:
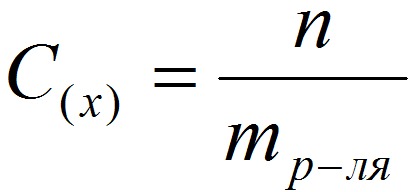
4.Титр – содержание вещества в граммах в 1 мл раствора:

5.Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:
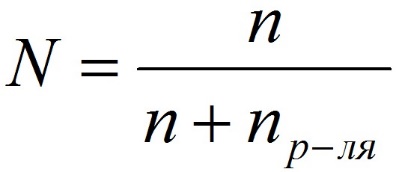
24. Основы теории электролитической диссоциации. Степень и константа диссоциации, закон разбавления Оствальда.
Основы теории электролитической диссоциации. Степень и константа диссоциации, закон разбавления Оствальда.
Электролитической диссоциацией называется процесс распада электролита на сольватированные ионы под действием молекул растворителя.
Степень диссоциации (α – греческая буква альфа) — это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N)

25. Диссоциация слабых электролитов на примере уксусной кислоты.
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например, уксусной кислоты:
CH3COOH
или синильной кислоты:
HCN
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов, чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее. Так, например, поскольку КHCN =6,210-10KCH3COOH = 1,810-5, то синильная кислота хуже диссоциирует и слабее, чем уксусная кислота.
