Файл: 1 Молекулярные кинетические представления о веществе все тела состоят из частиц атомов, молекул и ионов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.05.2024
Просмотров: 7
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1)Молекулярные – кинетические представления о веществе.
-
все тела состоят из частиц: атомов, молекул и ионов -
частицы находятся в непрерывном хаотическом движении (тепловом) -
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений
2)Агрегатные состояния.
Плазма, газообразное, твёрдое, жидкое.
3)Модель идеального газа.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией.
4)Уравнение состояния идеального газа.
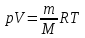
5)Молекулярно-кинетическое толкование давления газа.
Это есть результат ударов молекул газа о стенку.
6)Уравнение молекулярно-кинетической теории для давления.

7)Молекулярно-кинетическое толкование температуры.
1) Мера средней кинетической энергии молекул. Температура определяет средне квадратичную скорость движения молекул.
2) Физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
8)Средняя энергия хаотического движения молекул идеального газа.
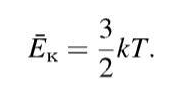
Усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
9)Распределение Максвелла – распределение молекул по скоростям.
Максвелл допустил, что в газах в состоянии теплового равновесия существует некоторое распределение скоростей, не изменяющееся с течением времени, иными словами, число молекул, имеющих скорости в заданном интервале значений, остается постоянным.
10)Распределение Максвелла – распределение молекул по кинетическим энергиям.
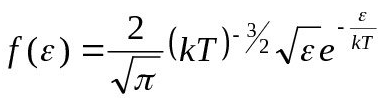
Для этого распределения характерно наличие экспоненциального множителя, в показателе которого стоят отношения кинетической энергии к величине пропорциональной средней энергии теплового движения молекул (kT).
11)Распределение Больцмана (распределение молекул по потенциальным энергиям во внешнем поле).
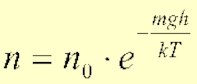
Для этого распределения характерно наличие экспоненциального множителя, в показателе которого стоят отношение потенциальной энергии к величине пропорциональной средней энергии теплового движения молекул (kT).
13) Явления переноса.
1)Перенос энергии: Теплопроводность - Способность материальных тел проводить тепловую энергию от более нагретых частей тела к менее нагретым частям тела путём хаотического движения частиц тела (Свойство тел проводить теплоту).
2)Перенос массы: Диффузия - это самопроизвольное взаимное проникновение молекул одного вещества в промежутки между молекулами другого.
3) Перенос импульса: Внутреннее трение(вязкость) - Одно из явлений переноса, свойство текучих тел оказывать сопротивление перемещению одной их части относительно другой. В результате макроскопическая работа, затрачиваемая на это перемещение, рассеивается в виде тепла.
14)Первое начало термодинамики.
Фундаментальный закон природы, установленный эмпирически и заключающийся в том, что для изолированной физической системы может быть введена скалярная физическая величина, являющаяся функцией параметров системы и называемая энергией, которая сохраняется с течением времени.(
полная механическая энергия замкнутой системы тел, взаимодействующих силами тяготения и упругости, остается неизменной.) 3) количество тепла ∆Q , сообщенное системе, идет на изменение внутренней энергии ∆U системы и на работу ∆A, совершаемую системой против внешних тел.
15)Политропические процессы.
Термодинамический процесс, во время которого теплоёмкость газа остаётся неизменной.
16)Классическая молекулярно-кинетическая теория теплоемкости.
Молекулярно-кинетическая теория теплоемкостей, основанная на предположении о наличии жесткой связи между атомами в молекуле, доказывает, что для газов одинаковой атомности изохорные молярные теплоемкости сохраняют постоянное значение, равное числу степеней свободы перемещения молекул газа (если теплоемкость измеряется в ккал).
17)Второе начало термодинамики.
Устанавливает существование энтропии как функции состояния термодинамической системы и вводит понятие абсолютной термодинамической температуры, то есть «второе начало представляет собой закон об энтропии» и её свойствах. В изолированной системе энтропия либо остаётся неизменной, либо возрастает, достигая максимума при установлении термодинамического равновесия.
18)Циклические процессы.
Круговые процессы в термодинамике, то есть такие процессы, в которых совпадают начальные и конечные параметры, определяющие состояние рабочего тела.
19)Тепловые машины.
Тепловой машиной называется периодический действующий двигатель, совершающий работу за счет получаемого извне тепла.
Тепловой машиной называется устройство, которое преобразует теплоту в работу или обратно и действует строго периодически, т.е. после завершения цикла возвращается в исходное состояние.
20)КПД тепловой машины.
Отношение
совершённой полезной работы машины к энергии, полученной от нагревателя.
21)Энтропия. Формула Больцмана
Энтропия характеризует степень необратимости, неидеальности реального термодинамического процесса. (функция состояния термодинамической системы) Мера вероятности состояния термодинамической системы.
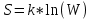
k – постоянная Больцмана, W – статистическая вероятность (число микро – состояний, реализующих данное макросостояние системы)
22)Третье начало термодинамики.
Физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю.
23)Реальные газы. Жидкое и кристаллическое состояния вещества.
1) Кристаллические состояние вещества - Твердые тела, имеющие упорядоченное, периодически повторяющееся расположение частиц (атомов, молекул, ионов).
2) Жидкое состояние вещества - вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями.
При этом агрегатное состояние жидкости, как и агрегатное состояние твёрдого тела является конденсированным, то есть таким, в котором частицы (атомы, молекулы, ионы) связаны между собой.
24)Реальные газы. Уравнение состояния Ван-дер-Ваальса.

Реальный газ - в общем случае, газообразное состояние реально существующего вещества.
25)Жидкое состояние вещества. Поверхностное натяжение. Капиллярные явления.
Капиллярные явления, совокупность явлений, обусловленных поверхностным натяжением на границе раздела несмешивающихся сред (в системах жидкость - жидкость, жидкость - газ или пар) при наличии искривления поверхности.
Термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
26)Кристаллические тела.
Это такие тела, атомы и молекулы которых расположены в определенном порядке, и этот порядок сохраняется на достаточно большом расстоянии.
28)Представление о квантовой теории теплоемкости.

29)Фазовые состояния и фазовые переходы.
Фазовый переход - Переход вещества из одной термодинамической фазы в другую при изменении внешних условий.
Газообразное, жидкое, кристаллическое (фазовые состояния).
30)Уравнение Клапейрона - Клаузиуса.

