Файл: Методические разработки для практических занятий по биотехнологии лекарственных средств.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 9
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Кабина, Н.А. К12 Основы биотехнологии. Рекомендации для подготовки к занятиям: учебно-методическое пособие / Н.А. Кабина, Е.И. Юшкова. – Орёл: ОГУ имени И.С. Тургенева, 2020. – 132 с. ISBN 978-5-9929-0859-6
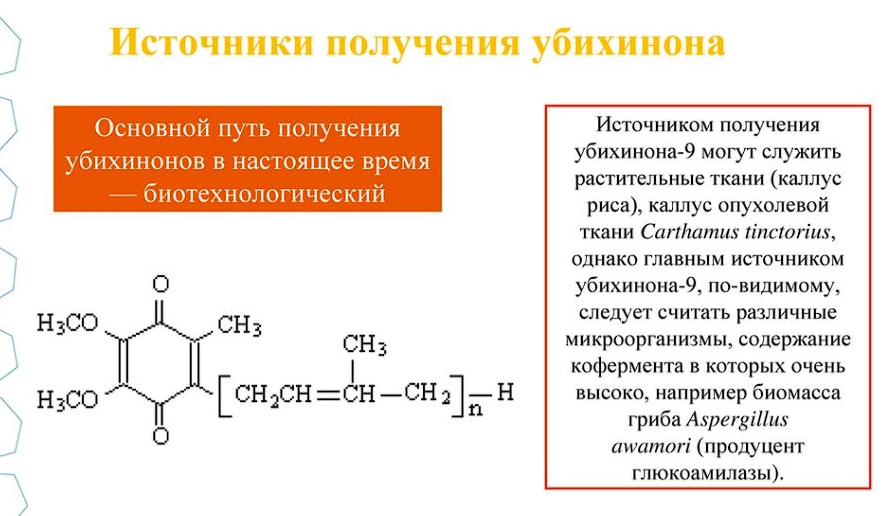
В производстве убихинонов применяются биотехнологические методы, в основе которых лежит экстракция KoQ из биологического материала. В промышленном производстве убихинонов в качестве субстрата используются как растительные ткани - каллус риса или опухолевые ткани Carthamus tinctorius, так и микроорганизмы с высоким содержанием убихинонов, например дрожжи Cryptococcus curvatus и грибы Candida maltosa.В настоящее время используется биотехнология получения убихинона-9 из микробных липидов, являющихся побочным продуктом крупного производства белково-витаминного концентрата при выращивании грибов Candida maltosa.Установлено, что биомасса уксуснокислых бактерий, которые используются в производстве аскорбиновой кислоты на этапе окисления d-сорбита в L-сорбозу, содержит значительное количество KoQ,n без примеси его гомологов. Причем, с одной стороны, эта биомасса является отходом производства аскорбиновой кислоты, с другой стороны, штаммы Gluconobacter oxydans в биомассе характеризуются наибольшей окислительной активностью по сорбиту. Это позволило внедрить совместную технологию получения L-сорбозы и экстракции убихинона-10 из отсепарированной биомассы с последующей очисткой и с выходом целевого продукта до 85 %.


-
Задание 6. Осуществлена гибридизация синтетического олигонуклеотида (праймера) со специфическим участком одной из цепей анализируемого участка ДНК. Раствор с праймером распределяют по четырём пробиркам, в каждой из которых находятся четыре дезоксинуклеотида и один из четырех дидезоксинуклеотидов. -
Опишите как называется этот метод? Укажите его цель -
зачем через некоторое время в пробирки добавляют формамид? -
дальнейшие этапы исследования и их цель -
современный вариант описанного метода. В чем его преимущество? -
описанные методы являются основными в какой науке? Опишите ее задачи -
приведите пример использования достижений этой науки в фармацевтической биотехнологии
Дидезоксинуклеотидный метод, или метод «обрыва цепи», был разработан Ф. Сенгером в 1977 году и в настоящее время широко используется для определения нуклеотидной последовательности ДНК. При секвенировании по Сенгеру происходит гибридизация синтетического олигонуклеотида длиной 17—20 звеньев со специфическим участком одной из цепей секвенируемого участка. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную группу для инициации синтеза цепи, комплементарной матрице.Раствор с праймером распределяют по четырём пробиркам, в каждой из которых находятся четыре дезоксинуклеотида, dATP, dCTP, dGTP и dTTP (один из них — меченный радиоактивным изотопом) и один из четырёх 2',3'-дидезоксинуклеотидов (ddATP, ddTTP, ddGTP или ddCTP). Дидезоксинуклеотид включается по всем позициям в смеси растущих цепей, и после его присоединения рост цепи сразу останавливается.В результате этого в каждой из четырёх пробирок при участии ДНК-полимеразы образуется уникальный набор олигонуклеотидов разной длины, включающих праймерную последовательность. Далее в пробирки добавляют формамид для расхождения цепей и проводят электрофорез в полиакриламидном геле на четырёх дорожках. Проводят радиоавтографию, которая позволяет «прочесть» нуклеотидную последовательность секвенируемого сегмента ДНК. В 1990-х метод Сенгера претерпел важные усовершенствования. Радиоактивное мечение заменили флуоресцентным. То есть к каждому из нуклеотидов-терминаторов присоединили флуоресцентную метку своего цвета. Это позволило совместить четыре реакции синтеза в одной пробирке, а также автоматизировать считывание электрофореза: продукты реакции детектировали фотодатчики на выходе из геля. Короткий фрагмент ДНК называемый праймером, инициирует синтез ДНК в определённой точке цепи ДНК-матрицы. Фермент - ДНК-полимераза синтезирует цепь ДНК полностью комплементарную последовательности ДНК матрицы. При этом видоизменённые разновидности нуклеотидов, которые присутствуют в реакционной смеси в значительно меньших количествах, чем обычные нуклеотиды, обрывают синтез, когда один из них оказывается на конце растущей ДНК-цепи. В результате получается смесь, содержащая полный набор ново- синтезированных фрагментов ДНК, каждый из которых начинается в одном и том же месте, но заканчивается во всех возможных положениях вдоль цепи ДНК-матрицы. Современные автоматизированные секвенаторы разделяют эти фрагменты, пропуская всю смесь через тончайшие капилляры, наполненные полимером. Чем короче фрагмент, тем быстрее он движется в геле по капилляру под действием электрического поля. Фрагменты ДНК - по сути, ионы, движущиеся в электрическом поле от «минуса» к «плюсу». Процесс, называемый капиллярным электрофорезом, настолько эффективен, что фрагмент, только что вышедший из капилляра, оказывается ровно на один нуклеотид длиннее, чем предшествующий ему. Во время электрофореза луч лазера в определенном месте геля возбуждает флуоресценцию красителей, и детектор определяет, какой нуклеотид в настоящий момент мигрирует через гель. Таким образом регистрируя последовательность появления нуклеотидов, прибор складывает «буквы» (нуклеотиды) в «текст» (последовательность ДНК). В настоящее время определение точной нуклеотидной последовательности любого сегмента ДНК умеренной длины - вполне разрешимая задача. Уже определена последовательность нескольких сотен генов про- и эукариот. Зная последовательность гена и генетический код, легко определить аминокислотную последовательность кодируемого им белка. Определение последовательности ДНК привело также к тому, что были обнаружены области, которые не кодируют белки, но принимают участие в регуляции экспрессии генов и репликации ДНК. В 1996 году был секвенирован геном дрожжей, в 1998 г. - геном арабидопсиса, в 2000 году - геном человека.
Области применения секвенаторов: секвенирование геномов de novo, SNP-типирование - онкология, секвенирование микроорганизмов, анализ родства.
Задание 7. Ген, кодирующий 14-звенный человеческий пептидный гормон, объединили с геном, кодирующим бета-галактозидазу кишечной палочки. Полученный гибрид ввели в бактериальные клетки.
Первые успешные результаты по экспрессии химически синтезированной последовательности нуклеотидов ДНК, кодирующей 14-звенный пептидный гормон соматостатин (антагонист соматотропина), получены в 1977 г. в США компанией «Генетек». Для предотвращения процесса разрушения гормона в бактериальных клетках под воздействием пептидазы авторы применили подход, который потом был успешно использован для получения других пептидных гормонов. Был сконструирован гибридный ген, часть которого была взята из гена фермента β-галактозидазы кишечной палочки, а остаток представлял собой фрагмент, кодирующий собственно соматостатин (фрагмент синтезировали химически). Введенный в бактериальные клетки гибридный ген направлял синтез белка-химеры, состоящего более чем на 90 % из аминокислотной последовательности β- галактозидазы. Остальная часть представляла собой соматостатин. На стыке участка двух исходных генов находился кодон аминокислоты метионина. Последнее позволило обработать гибридный белок бромцианом, разрывающим пептидную связь, образованную метионином; среди продуктов расщепления был обнаружен соматостатин. Данный подход был использован для получения многих пептидных гормонов (А- и В-цепей инсулина, нейропептида лейэнкефалина, брадикинина, ангиотензина и др.).
Генноинженерными методами за короткий срок были созданы микро- организмы-суперпродуценты, позволяющие получать с высокими выходами ряд белков вирусов и животных. Созданы штаммы, у которых до
131
20 % клеточного белка составляют генноинженерные продукты, например, коровий антиген вируса гепатита В, главный капсидный антиген вируса ящура, реннин теленка, поверхностный антиген вируса гепатита В и др.
Получение рекомбинантного инсулина
-
Получение какого гормона описано в условии? Опишите его значение для человека ? Получение рекомбинантного соматотропина . Для лечения карликовости, В 1980 г. были получены доказательства того, что генноинженерный соматотропин обладает биологической активностью нативного гормона. Клинические испытания препарата также прошли успешно. В 1982 г. гормон был получен также на основе сконструированной кишечной палочки в Институте Пастера в Париже. Стоимость гормона к 1990 г. снизилась до 5 долларов/ед.
-
Какие ферменты необходимы для осуществления этапов, описанных в условии? -
Подробно опишите дальнейшие действия по получению целевого продукта -
опишите преимущества получения человеческих белков таким способом -
Целесообразно ли было сразу ввести человеческий ген в бактериальные клетки, минуя стадию создания гибридного гена? Ответ объясните
Генноинженерный препарат имеет несомненные преимущества: доступен в больших количествах, гомогенен, не содержит вирусов.
