Файл: 1. Затты агрегатты кйлерін сипаттаыз Затты агрегатты кйлері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 12
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1-билет
1. Заттың агрегаттық күйлерін сипаттаңыз
Заттың агрегаттық күйлері дегеніміз бұл - газ, сұйық және қатты күй. Мысалы су, су бөлменің оң температураларында сұйық боп ағады, аязды күндерде су далада мұз боп қатады, шәйнектегі су қайнап буға айналып газ күйінде болады.
Заттардың агрегаттық күйлері молекулалар мен атомдардың орналасуына байланысты.
Газдарда молекулалар мен атомдар бір-бірінен алыс орналасады, ал сұйықтар мен қатты заттарда молекулалар мен атомдар бір-біріне жақын орналасады.
Сұйық пен қатты заттардың атомдары мен молекулалары тығыз орналасқандықтан, заттың бұндай агрегаттық күйлерінде заттың көлемі тұрақты болады. Сұйық пен қатты заттарды соңдықтан сығу қиын болады. Молекулалар мен атомдардың арақашықтарын өзгерту қиын болғандықтан.
Қатты заттардың атомдары көбінесе кристалдық тор пішінді болады.
Кристалды тор дегеніміз атомдардың тор сияқты бір тәртіппен орналасуы, бұндай құрылым қатты заттарға тән. Қатты заттың атомдары кристалдық торды құратындықтан, бұндай заттың - пішінің өзгерту, сығу, қысу қиын болады. Металдардың серпінділігі бұндай құрылымнан туындайды.
Ал газдарда молекулалар мен атомдар қашық орналасқандықтан газдарды сығу оңай болады. Газ көлемін көп күш жұмсамай-ақ кішірейте аламыз, және де газдардың тығыздықтары да осы себептен аз болады.
Сұйық денелерде молекулалар мен атомдар қатты денелерге қарағанда қашық орналасады. Сұйық заттарда молекулалар тәртіпсіз орналасады. Сұйық заттар осы себептен аққыш болады. Сұйықтар ыдыстың пішінің қабылдайды.
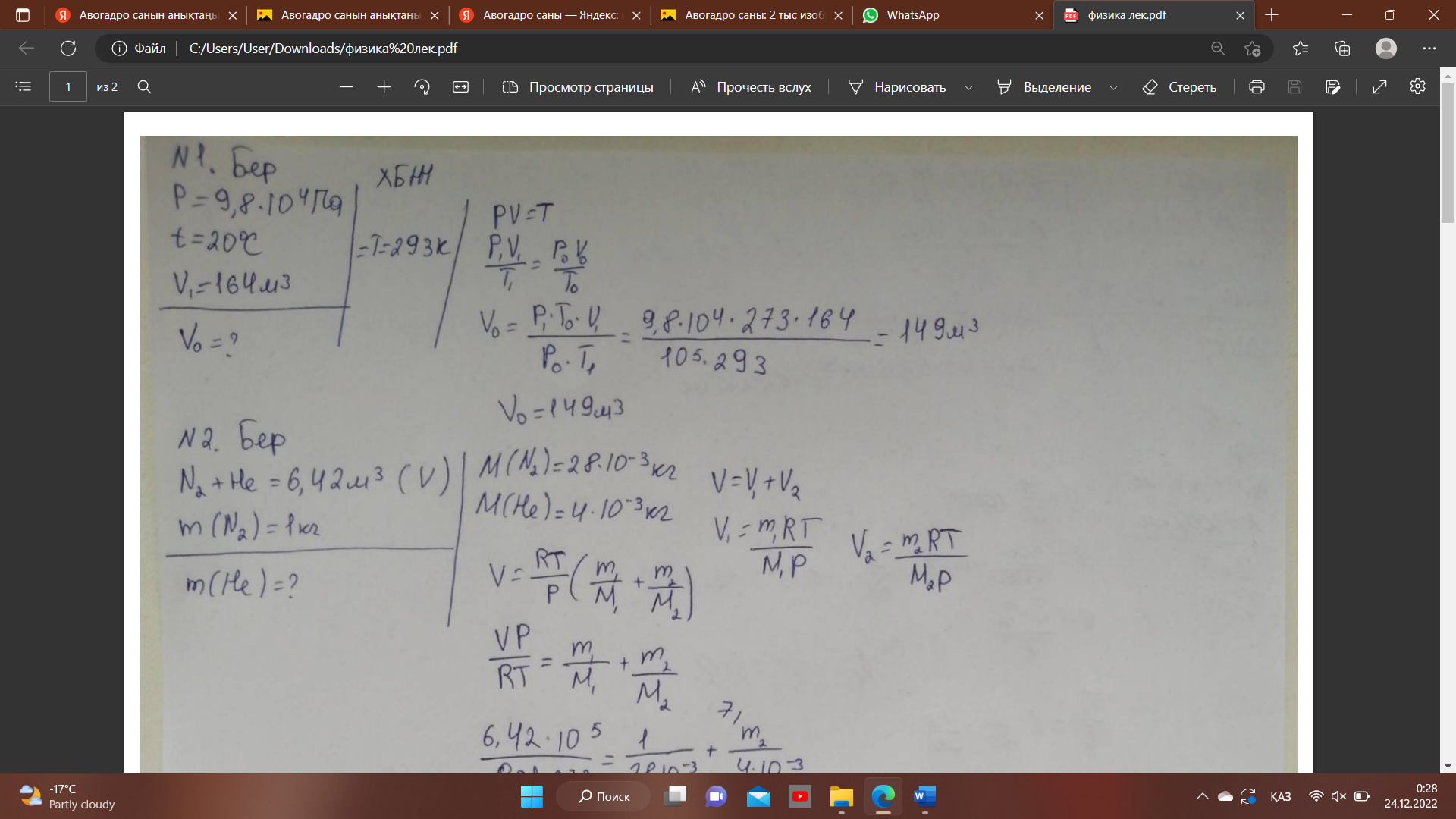
2. Авогадро санын анықтаңыз.
Авогадро тұрақтысы, Авогадро саны — заттың 1 моліндегі құрылымдық элементтер (атом, молекула, ион, т. б. бөлшектер) саны; NA түрінде белгіленеді. Италия ғалымы Амадео Авогадроның (1776—1856) есімімен аталған. Авогадро тұрақтысының анықталған дәл мәні:
NA = 6,022 141 79(30)×1023 моль−1. Формуласы: N=N/n.
Авогадро тұрақтысы массаның атомдық бірлігін килограммен (Халықаралық бірліктер жүйесіндегі масса бірлігі) теңдестіруге болады: 1 м. а. б. = (10−3 кг×моль−1) / NA.
Авогадро саны - бұл мольдегі газ молекулаларының саны. Бұл сан өте үлкен, қазіргі көрсеткіш - 6.022 x 1023. Авогадроның
өлшем бірлігі - mol-1. Бұл қарастырылып отырған субъектінің өлшемі бір мольге тең екенін білдіреді. Авогадроның нөмірі әдетте шартты түрде бейнеленеді Н.

3.
2-билет
1. Молекулалық кинетикалық теориясын сипаттаңыз.
ХІХ ғасырдың екінші жартысы мен ХХ ғасырдың басында экспериментік негіздеудің нәтижесінде молекулалардың өзара әрекеттесуін және қозғалыстарын сипаттайтын келісті теория молекула-кинетикалық теорияжасалды.
Заттардың құрылысы туралы молекула-кинетикалық теорияның негізгі қағидалары:
1. Барлық дене (зат) белгілі бір арақашықтықта орналасқан бөлшектерден тұрады (молекула, атом, иондар).
Тәжірибелік дәлелдеу (негіздеу)
- заттың ұсақталуы, - заттардың араласуы (диффузия),
- сұйықтың булануы, - тунелді микроскоптың суретке түсіруі.
2. Заттың құрамындағы атомдар мен молекулалар үздіксіз хаосты қозғалыста болады.
3. Бөлшектер арасында молекулалық өзара әсерлер болады (тартылу, тебілу).
Тәжірибелік негіздеме:
- Қатты дене пішінінің сақталуы.
- Бөлшектер белгілі арақашықтықта болуы.
- Денелердің серпімділігі.
- Денелердің өңделген беттерінің жабысуы.
Керек болса;
2

. Идеал газ. Идеал газ заңдары. Идеал газ күйінің теңдеуін түсіндіріңіз.
Идеал газ – бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі.
Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен – Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль–Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі.
Идеал газдардың негізгі қасиеттері:
a) Молекулалар – материалды нүктелер (абсолют серпімді шарлар)
әә) Молекулалар қозғалысы Ньютон заңдарына бағынады
бб)Молекулалар арасында өзара әсер жоқ (Ep=0;Ek≠0)
вв) Молекулалар хаосты қозғалыста
гг) Қарастырылып отырған ең аз көлемде бөлшектер (молекулалар) саны көп мөлшерде болады. Авогадро санымен салыстырылады
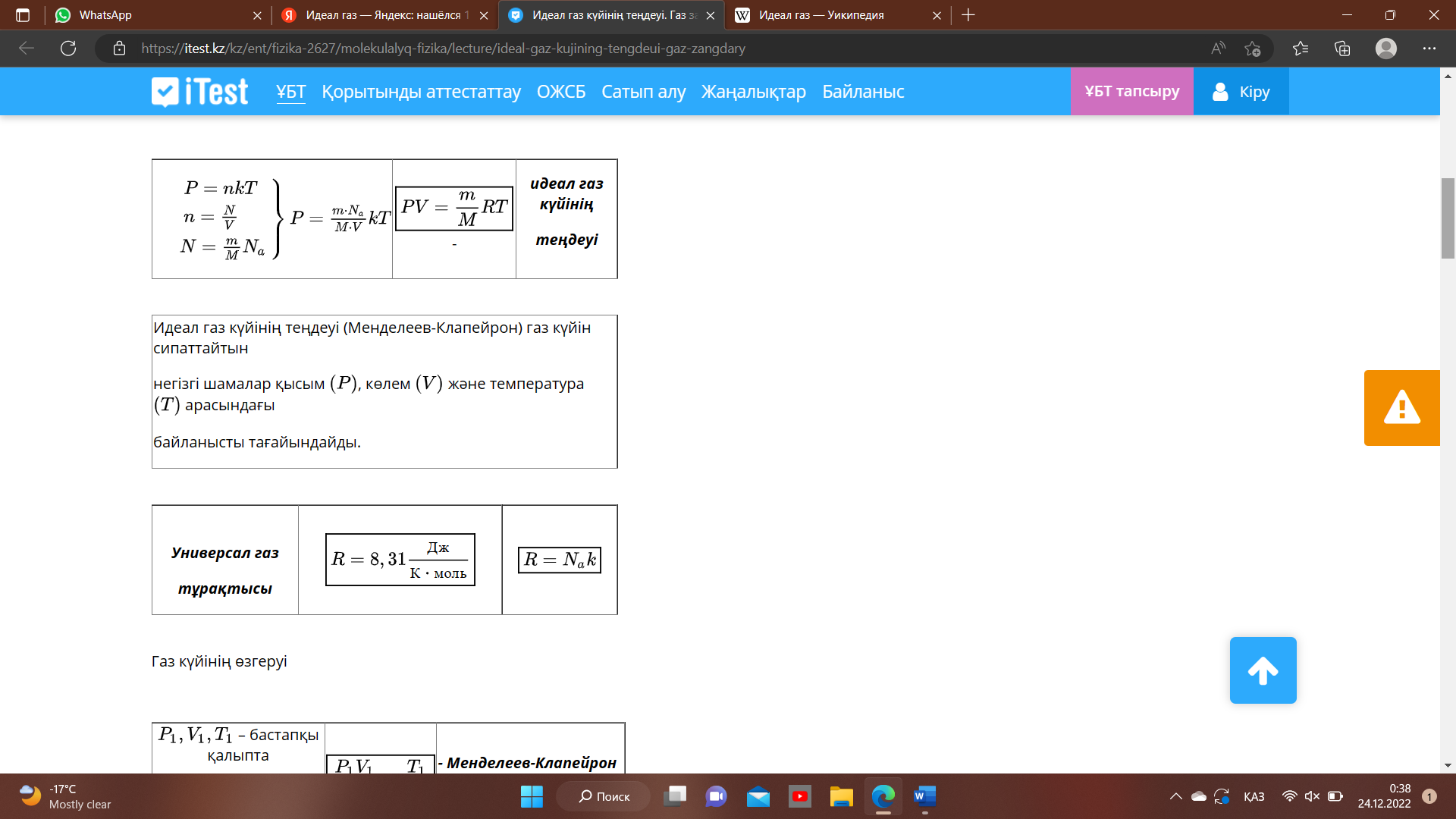
Идеал газдың жайын MKT тұрғысынан үш макроскопиялық шамалардың (P,V,T) арасындағы байланысты қарастыратын теңдеу - идеал газ күйінің теңдеуі деп аталады.
Бұл теңдеуді орыс ғалымы Д.И. Менделеев қорытып шығарды.
Идеал газдар бағынатын заңдар әлдеқашан ашылған болатын. Бұл заңдардың барлығын да кинетикалық теория теңдеуінен шығарып алуға болады.
Бойль-Мариотт заңы.Газды тұрақты температура кезінде қарастырсақ, мұндай шарттар изотермиялық деп аталады. Егер (10.9) теңдеуінде
Гей Люссак заңы. Енді газдың
өзгеріссіз қалады:
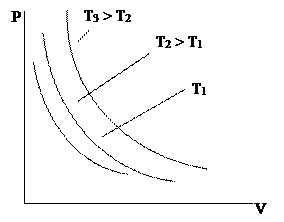
Изобара теңдеуідеп аталатын бұл теңдеу Гей-Люссак заңының математикалық өргені болып табылады; Изобара графигі
жоғарыдағы өрнектен көріп отырғанымыздай, координаттар басынан шығатын түзу болып табылады.
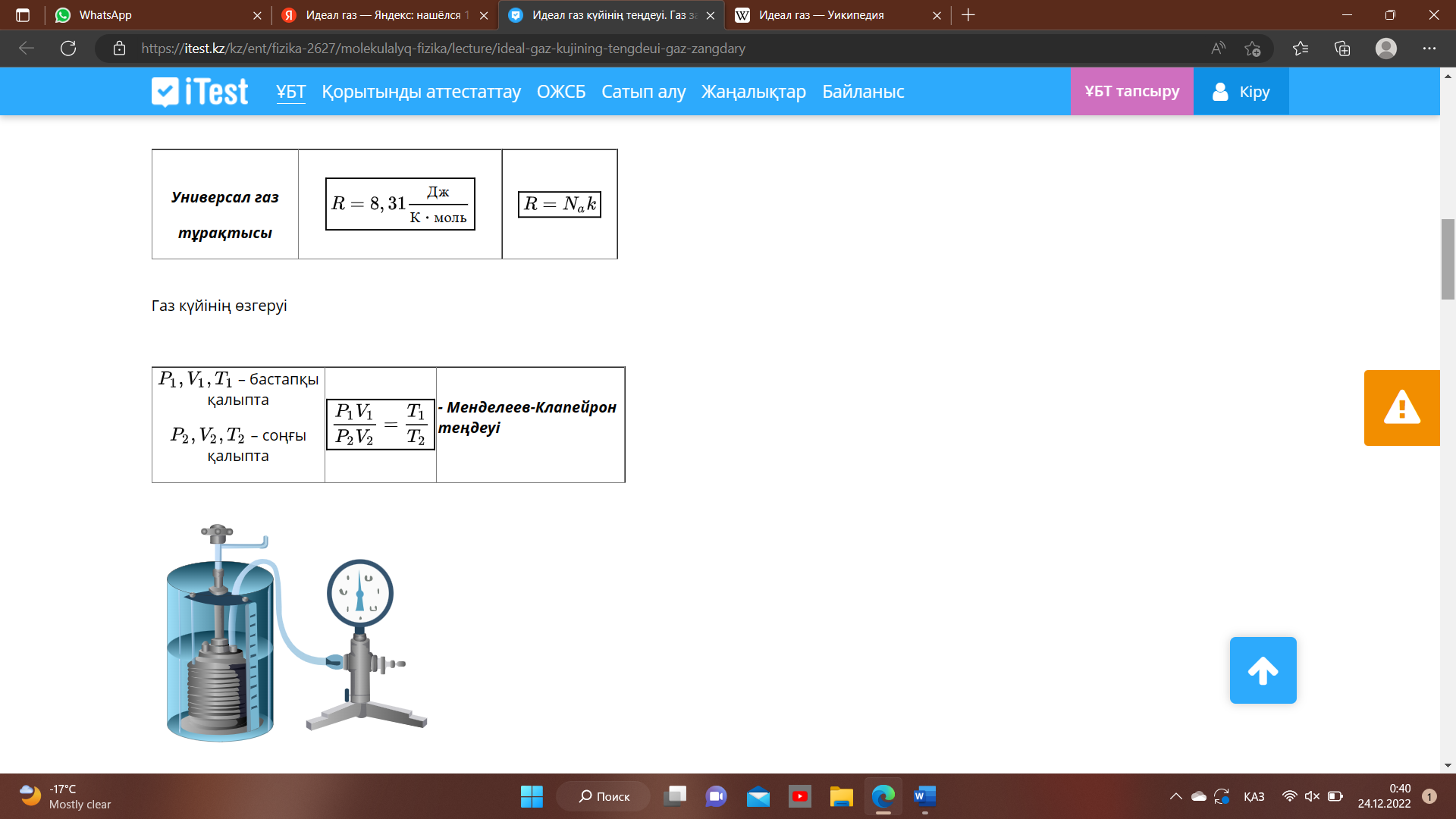
Шарль заңы. Егер процесс кезінде газдың көлемі өзгеріссіз қалатын болса, онда газ күйі теңдеуінен
Идеал газ күйінің теңдеуі
Молекула-кинетикалық негізінде алынған теңдеулер газ күйін анықтайтын шамаларды өзара байланысатын қатарларды табуға мүмкіндік береді. Бұл шамаларға газдың қысымы
Идеал газдар үшін күй теңдеуін кинетикалық теорияның негізгі
тең. Егер
Бұл теңдеуге барлық үш күй параметрлері де кіреді, сондықтан да ол идеал газ күйінің теңдеуі болып табылады.
3.
3-билет
1. Молекулалық кинетикалық теориясын сипаттаңыз.
ХІХ ғасырдың екінші жартысы мен ХХ ғасырдың басында экспериментік негіздеудің нәтижесінде молекулалардың өзара әрекеттесуін және қозғалыстарын сипаттайтын келісті теория молекула-кинетикалық теорияжасалды.
Заттардың құрылысы туралы молекула-кинетикалық теорияның негізгі қағидалары:
1. Барлық дене (зат) белгілі бір арақашықтықта орналасқан бөлшектерден тұрады (молекула, атом, иондар).
Тәжірибелік дәлелдеу (негіздеу)
- заттың ұсақталуы, - заттардың араласуы (диффузия),
- сұйықтың булануы, - тунелді микроскоптың суретке түсіруі.
2. Заттың құрамындағы атомдар мен молекулалар үздіксіз хаосты қозғалыста болады.
3. Бөлшектер арасында молекулалық өзара әсерлер болады (тартылу, тебілу).
Тәжірибелік негіздеме:
- Қатты дене пішінінің сақталуы.
- Бөлшектер белгілі арақашықтықта болуы.
- Денелердің серпімділігі.
- Денелердің өңделген беттерінің жабысуы.
Керек болса;
2

. Энергияның сақталу заңын түсіндіріңіз.
Тұйық, оқшауланған жүйенің толық энергиясы тұрақты боп тұрады.
Яғни энергияның жалпы мөлшері, тұйық жүйеде өзгермейді. Артпайды да, кемімейді де Энергияның сақталу заңы дегеніміз осы. Төменде бұл заңның механикадағы және термодинамикадағы мысалдары келтірілген.
Энергияның сақталу заңының механикалық жүйеде орындалуы
Механикада денеде екі түрлі энергия бар болады - кинетикалық және потенциалдық энергиялары. Осы екі энергияның қосындысы, өзге күштер әсер етпегенде, тұрақты болады.
Мысалы бала допты жоғары лақтырса (ауа кедергісі жоқ деп есептейік) допқа кинетикалық энергия береді де доп жоғары қарай көтеріле бастайды, доп максималды биіктікке көтерілгенде доптың кинетикалық энергиясы толығымен потенциалдық энергияға айналады.
