Файл: 1. Затты агрегатты кйлерін сипаттаыз Затты агрегатты кйлері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
и 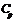 .
.
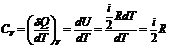 , (12.4)
, (12.4)
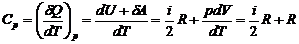 . (12.5)
. (12.5)
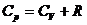 . (12.6)
. (12.6)
Бұл өрнекті Майер формуласы деп атайды.
Жылу сыйымдылықтардың қатынасы адиабата көрсеткіші деп аталады:
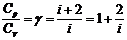 . (12.7)
. (12.7)
2. Джоуль-Томсон эффектісі
Тек нақты газдарда болатын бұл құбылысты Джоуль-Томсон эффектісі дейді. Егер ұлғаю кезінде газдың температурасы төмендесе, Джоуль-Томсон эффектісін оң дейді, ал егер газдың температурасы жоғарласа – теріс дейді.
ДЖОУЛЬ-ТОМСОН ЭФФЕКТІСІ – газ температурасының адиабаттық дросселдеу – газдың тұрақты түрдегі қысым айырмашылығы әсерінен дроссель арқылы баяу ағуы – газ ағынына жергілікті бөгеуіл (мысалы, газ ағынына қойылған кеуекті бөгет) нәтижесінде өзгеруі. Бұл құбылысты 1852–62 жылдары ағылшын физиктері Джеймс Джоуль (1818 – 1889) мен Уильям Томсон (Кельвин) (1824 – 1907) ашып, зерттеген. Дж. Джоуль мен У. Томсонның тәжірибелерінде газдың үздіксіз әрі тұрақты ағынында тізбектелген екі қималардағы температура (дросселге дейінгі және одан кейінгі) өлшенген. Газдың дроссельдегі едәуір үй- келісі салдарынан газ ағынының жылдамдығы өте баяу болған және дроссельдеу кезінде ағынның кинетикалық энергиясы іс жүзінде өзгермеген. Құбыр және дроссельдің қабырғаларының жылуөткізгіштігі төмен болғандықтан газ бен сыртқы орта арасында жылуалмасу болмаған. Дроссельдегі қысым айырмашы- лығы (Δр=р1 – р2), атмосфералық қысымға тең, өлшенген температура айырымы ΔТ=Т2 – Т1 ауа үшін – 0,25°С (тәжірибе бөлме температурасында орындалған) болған кезде СО2 және Н2 үшін әлгі жағдайда ΔТ сәйкес түрде – 1,25 және + 0,02°С-ке тең болған. Егер газ дроссельдеу кезінде салқындайтын (Δ
Т<0) болса, Джоуль-Томсон эффектісі оң деп, ал егер – қызатын (ΔТ>0) болса, теріс деп атау қабылданған.
Заттар құрылысының молекулалық-кинетикалық теориясы бойынша ДжоульТомсон эффектісі газда молекулааралық өзараәсерлесу күштерінің болатынының дәлелі болды (бұл тәжірибе осы күштерді анықтау үшін орындалған болатын). Шындығында, молекулалардың өзара тартылысы кезінде газдың ішкі энергиясы (U) өзіне молекулалардың өзараәсерлесуінің кинетикалық энергиясын да, әрі потенциалдық энергиясын да қосып алады. Газдың энергетикалық оқшаулану жағдайларында ұлғаюы оның ішкі энергиясын өзгертпейді, бірақ та молекулалардың өзараәсерлесуінің потенциалдық энергиясын арттырады (молекулалардың ара қашықтықтары артады). Молекулалардың жылулық қозғалысының баяулауының нәтижесінде ұлғаюшы газдың температурасы кемитін болады. Нақты үрдіс күрделірек, себебі газ сыртқы ортадан энергетикалық оқшауланбаған. Үрдіс сыртқы жұмысты жүзеге асырады (газдың келесі мөлшері алдыңғысын нығыздай түседі).
Молекуласы материалдық нүкте ретінде қарастырылатын, бір-бірімен өзараәсерлеспейтін идеал газ үшін Джоуль-Томсон эффектісі нөлге тең. Бір газдың өзі дроссельдеудің жағдайына тәуелді түрде қыза да және салқындай да алады.
6-билет
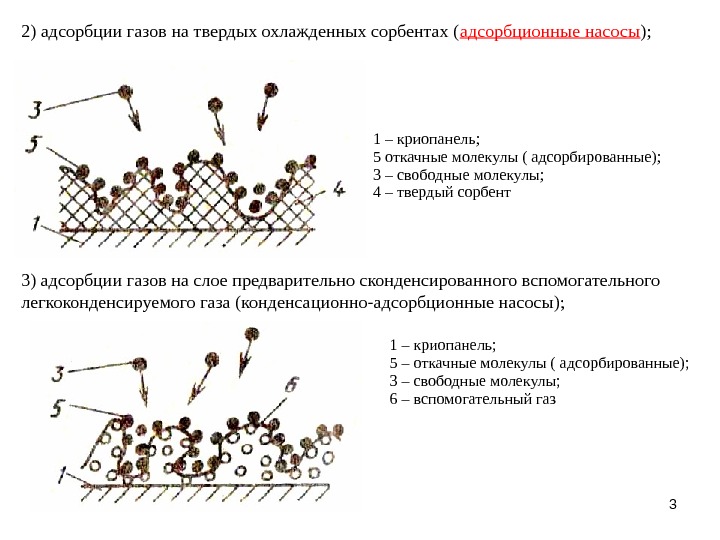
1. Қатты денелердің газды абсорбциялауы және адсорбциялауын сипаттаңыз.
Cорбция деп (латын тілінен sorbeo –сіңіру) қандайда бір затты (сорбтивті) басқа бір затпен (сорбитпен) сіңірудің кез –келген үрдісін атайды.Механизіміне байланысты сіңіруді адцорбционды, абсорбционды, хемосорбционды және копилярлы конденсациялы деп айырады. Сорбционды үрдістерді сорбцияны қолданып бірдейлі және бірдей емес жүйеден бөлу үшін қолданады.
Абсорбция – барлық сорбинт көлеміндегі бір заттың басқа затпен сіңірілуі. Абсорбция мысал ретінде газдың сұйықтықта еруін айтады. Бұндай үрдісте сіңірілетін затты –абсорбат дейді, ал сіңіретіндерді –абсорбент дейді.
Адсорбция – фазаның бөлу шегінде зат концентарциясының өзгеруі байқалады. Бұл кез –келегн фаза арасының бетінде жүреді және де кез –келген затта адсорбилене алады. Адсорбционды теңдік, демек шектік қабаттың және шектік фазаның арасындағы заттың тең орналасуы динамикалы болады және тез құрылады. Бұндай үрдісте сіңіретін затты –адсорбат,сіңірілетінді –адсорбент деп атайды.
Газдардың қатты заттарға адсорбциясы жылу бөлінуімен жүретін экзотермиялық процесс. Кері процесс – десорбция – жылуды сіңірумен бірге жүретін эндотермиялық процесс. Сондықтан Ле Шателье принципіне сәйкес қатты денелердің газдардың адсорбциясы температураның жоғарылауымен азаяды. Молекулалық-кинетикалық тұрғыдан алғанда температураның жоғарылауымен адсорбцияның төмендеуі адсорбат молекулаларының жылулық қозғалысының қарқындылығының жоғарылауымен байланысты екені анық. Адсорбенттің бірдей массасы үшін беттің меншікті ауданы артқан сайын адсорбция артады.
2. Молекулалық-кинетикалық теорияның үш қағидасын түсіндіріңіз.
Молекулалы-кинетикалық теория-модельдер әдісін қолданатын теорияның мысалы. Модельдер әдісінің ерекшелігі - күрделі объектінің қасиеттерін экспериментті зерттеу нәтижесінде оның ішкі құрылымы және құрайтын бөліктерінің қасиеттері туралы гипотеза айту. Айтылған гипотеза зерттелген объектінің белгілі қасиеттерін түсіндіру керек және жаңа, бұрын белгісіз қасиеттерді немесе зандылықтарды болжау керек. Егер бұл болжаулар тәжірибеде расталса, онда гипотеза теорияның негізі болады. Физикалық объектінің немесе құбылыстың кез келген моделі - олардың қарапайымдалған, идеалданған суреттемесі.
Молекулалы-кинетикалық теорияның негізгі қағидалары
Молекулалы-кинетикалық теорияның объектісі - қатты, сұйық және газ тәрізді күйлердегі зат. Химиялық заттың ең кішкентай бөлшектері атомдар және молекулалар бар болатынын пайымдайтын ілім - молекулалы-кинетикалық теория.
Заттың атомдардан, ең кішкентай бөлінбейтін бөлшектерден құралатыны туралы гипотезаны бұдан 2500 жылдай бұрын көне грек ғалымдары Левкипп және Демокрит айтқан. Бұл гипотеза газ, сұйық және қатты денелердің негізгі механикалық қасиеттерін: газдың шексіз таралуын, заттардың серпімділігін, олардың диффузия арқылы өзара бір-біріне енуін түсіндіре алды.
Молекулалы-кинетикалық теорияның негізінде келесі қағидалар жатыр.
Барлық денелер атомдардан құралады. Атомдар деп заттың ең кішкентай бөлінбейтін бөлшектерін атайды. Бір қарапайым химиялық заттың барлық атомдары бірдей.
Атомдар үздіксіз ретсіз қозғалыста болады. Атомдарды өзара бір-біріне тартатын күштер бар. Өте жақын қашықтықта атомдар бір-бірін тебеді. :
Екі немесе көп атомнан тұратын заттың өте кішкентай бөлшектері молекулалар деп аталады.
Атомдардың және молекулалардың қозғалысы, олардың өзара әрекеті механика заядары арқылы суреттеледі.
Соңғы тұжырым ретсіз қозғалған кішкентай өте көп бөлшектерден құралған денелердің қасиеттерін анықтау үшін механиканың негізгі заңдарын қолдануға мүмкіншілік тудырады.
Бұл өрнекті Майер формуласы деп атайды.
Жылу сыйымдылықтардың қатынасы адиабата көрсеткіші деп аталады:
2. Джоуль-Томсон эффектісі
Тек нақты газдарда болатын бұл құбылысты Джоуль-Томсон эффектісі дейді. Егер ұлғаю кезінде газдың температурасы төмендесе, Джоуль-Томсон эффектісін оң дейді, ал егер газдың температурасы жоғарласа – теріс дейді.
ДЖОУЛЬ-ТОМСОН ЭФФЕКТІСІ – газ температурасының адиабаттық дросселдеу – газдың тұрақты түрдегі қысым айырмашылығы әсерінен дроссель арқылы баяу ағуы – газ ағынына жергілікті бөгеуіл (мысалы, газ ағынына қойылған кеуекті бөгет) нәтижесінде өзгеруі. Бұл құбылысты 1852–62 жылдары ағылшын физиктері Джеймс Джоуль (1818 – 1889) мен Уильям Томсон (Кельвин) (1824 – 1907) ашып, зерттеген. Дж. Джоуль мен У. Томсонның тәжірибелерінде газдың үздіксіз әрі тұрақты ағынында тізбектелген екі қималардағы температура (дросселге дейінгі және одан кейінгі) өлшенген. Газдың дроссельдегі едәуір үй- келісі салдарынан газ ағынының жылдамдығы өте баяу болған және дроссельдеу кезінде ағынның кинетикалық энергиясы іс жүзінде өзгермеген. Құбыр және дроссельдің қабырғаларының жылуөткізгіштігі төмен болғандықтан газ бен сыртқы орта арасында жылуалмасу болмаған. Дроссельдегі қысым айырмашы- лығы (Δр=р1 – р2), атмосфералық қысымға тең, өлшенген температура айырымы ΔТ=Т2 – Т1 ауа үшін – 0,25°С (тәжірибе бөлме температурасында орындалған) болған кезде СО2 және Н2 үшін әлгі жағдайда ΔТ сәйкес түрде – 1,25 және + 0,02°С-ке тең болған. Егер газ дроссельдеу кезінде салқындайтын (Δ
Т<0) болса, Джоуль-Томсон эффектісі оң деп, ал егер – қызатын (ΔТ>0) болса, теріс деп атау қабылданған.
Заттар құрылысының молекулалық-кинетикалық теориясы бойынша ДжоульТомсон эффектісі газда молекулааралық өзараәсерлесу күштерінің болатынының дәлелі болды (бұл тәжірибе осы күштерді анықтау үшін орындалған болатын). Шындығында, молекулалардың өзара тартылысы кезінде газдың ішкі энергиясы (U) өзіне молекулалардың өзараәсерлесуінің кинетикалық энергиясын да, әрі потенциалдық энергиясын да қосып алады. Газдың энергетикалық оқшаулану жағдайларында ұлғаюы оның ішкі энергиясын өзгертпейді, бірақ та молекулалардың өзараәсерлесуінің потенциалдық энергиясын арттырады (молекулалардың ара қашықтықтары артады). Молекулалардың жылулық қозғалысының баяулауының нәтижесінде ұлғаюшы газдың температурасы кемитін болады. Нақты үрдіс күрделірек, себебі газ сыртқы ортадан энергетикалық оқшауланбаған. Үрдіс сыртқы жұмысты жүзеге асырады (газдың келесі мөлшері алдыңғысын нығыздай түседі).
Молекуласы материалдық нүкте ретінде қарастырылатын, бір-бірімен өзараәсерлеспейтін идеал газ үшін Джоуль-Томсон эффектісі нөлге тең. Бір газдың өзі дроссельдеудің жағдайына тәуелді түрде қыза да және салқындай да алады.
6-билет
1. Қатты денелердің газды абсорбциялауы және адсорбциялауын сипаттаңыз.
Cорбция деп (латын тілінен sorbeo –сіңіру) қандайда бір затты (сорбтивті) басқа бір затпен (сорбитпен) сіңірудің кез –келген үрдісін атайды.Механизіміне байланысты сіңіруді адцорбционды, абсорбционды, хемосорбционды және копилярлы конденсациялы деп айырады. Сорбционды үрдістерді сорбцияны қолданып бірдейлі және бірдей емес жүйеден бөлу үшін қолданады.
Абсорбция – барлық сорбинт көлеміндегі бір заттың басқа затпен сіңірілуі. Абсорбция мысал ретінде газдың сұйықтықта еруін айтады. Бұндай үрдісте сіңірілетін затты –абсорбат дейді, ал сіңіретіндерді –абсорбент дейді.
Адсорбция – фазаның бөлу шегінде зат концентарциясының өзгеруі байқалады. Бұл кез –келегн фаза арасының бетінде жүреді және де кез –келген затта адсорбилене алады. Адсорбционды теңдік, демек шектік қабаттың және шектік фазаның арасындағы заттың тең орналасуы динамикалы болады және тез құрылады. Бұндай үрдісте сіңіретін затты –адсорбат,сіңірілетінді –адсорбент деп атайды.
Газдардың қатты заттарға адсорбциясы жылу бөлінуімен жүретін экзотермиялық процесс. Кері процесс – десорбция – жылуды сіңірумен бірге жүретін эндотермиялық процесс. Сондықтан Ле Шателье принципіне сәйкес қатты денелердің газдардың адсорбциясы температураның жоғарылауымен азаяды. Молекулалық-кинетикалық тұрғыдан алғанда температураның жоғарылауымен адсорбцияның төмендеуі адсорбат молекулаларының жылулық қозғалысының қарқындылығының жоғарылауымен байланысты екені анық. Адсорбенттің бірдей массасы үшін беттің меншікті ауданы артқан сайын адсорбция артады.

2. Молекулалық-кинетикалық теорияның үш қағидасын түсіндіріңіз.
Молекулалы-кинетикалық теория-модельдер әдісін қолданатын теорияның мысалы. Модельдер әдісінің ерекшелігі - күрделі объектінің қасиеттерін экспериментті зерттеу нәтижесінде оның ішкі құрылымы және құрайтын бөліктерінің қасиеттері туралы гипотеза айту. Айтылған гипотеза зерттелген объектінің белгілі қасиеттерін түсіндіру керек және жаңа, бұрын белгісіз қасиеттерді немесе зандылықтарды болжау керек. Егер бұл болжаулар тәжірибеде расталса, онда гипотеза теорияның негізі болады. Физикалық объектінің немесе құбылыстың кез келген моделі - олардың қарапайымдалған, идеалданған суреттемесі.
Молекулалы-кинетикалық теорияның негізгі қағидалары
Молекулалы-кинетикалық теорияның объектісі - қатты, сұйық және газ тәрізді күйлердегі зат. Химиялық заттың ең кішкентай бөлшектері атомдар және молекулалар бар болатынын пайымдайтын ілім - молекулалы-кинетикалық теория.
Заттың атомдардан, ең кішкентай бөлінбейтін бөлшектерден құралатыны туралы гипотезаны бұдан 2500 жылдай бұрын көне грек ғалымдары Левкипп және Демокрит айтқан. Бұл гипотеза газ, сұйық және қатты денелердің негізгі механикалық қасиеттерін: газдың шексіз таралуын, заттардың серпімділігін, олардың диффузия арқылы өзара бір-біріне енуін түсіндіре алды.
Молекулалы-кинетикалық теорияның негізінде келесі қағидалар жатыр.
Барлық денелер атомдардан құралады. Атомдар деп заттың ең кішкентай бөлінбейтін бөлшектерін атайды. Бір қарапайым химиялық заттың барлық атомдары бірдей.
Атомдар үздіксіз ретсіз қозғалыста болады. Атомдарды өзара бір-біріне тартатын күштер бар. Өте жақын қашықтықта атомдар бір-бірін тебеді. :
Екі немесе көп атомнан тұратын заттың өте кішкентай бөлшектері молекулалар деп аталады.
Атомдардың және молекулалардың қозғалысы, олардың өзара әрекеті механика заядары арқылы суреттеледі.
Соңғы тұжырым ретсіз қозғалған кішкентай өте көп бөлшектерден құралған денелердің қасиеттерін анықтау үшін механиканың негізгі заңдарын қолдануға мүмкіншілік тудырады.
