ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 33
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 2 четверть
Продолжительность - 40 минут
Количество баллов -25
Типы заданий:
МВО – задания с множественным выбором ответов;
КО – задания, требующие краткого ответа;
РО – задания, требующие развернутого ответа.
Структура суммативного оценивания
Данный вариант состоит из 12 заданий, включающих задания с множественным выбором ответов, с кратким и развёрнутым ответами.
В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах, требующих развёрнутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Задание может содержать несколько структурных частей/подвопросов.
Характеристика заданий суммативного оценивания за 2 четверть
| Раздел | Проверяемые цели | Уровень мыслительны х навыков | Кол. заданий* | № задания* | Тип задания* | Время на выполнени е, мин* | Балл* | Балл за раздел |
| 8.2А Количество вещества | 8.1.1.2 -вычислять массу, количество вещества и число структурных частиц | Применение | 2 | 1 3 | МВО/ КО | 5 | 1 2 | 3 |
| 8.2.В Стехиометри ческие расчеты | 8.2.3.5 -вычислять массу, количество вещества по уравнениям химических реакций | Применение | 1 | 4 | РО | 4 | 4 | 6 |
| 8.2.3.6 -знать закон Авогадро и использовать молярный объем для расчета объема газов при нормальных и стандартных условиях; | Применение | 1 | 5 | КО | 3 | 2 | ||
| 8.2С Знакомство с энергией в химических реакциях | 8.3.1.1 -понимать, что продуктами реакций горения являются оксиды, и что при горении углеродсодержащего горючего в кислороде могут образовываться углекислый газ, угарный газ или углерод | Знание и понимание | 1 | 2 | МВО | 3 | 1 | 6 |
| 8.3.1.3 -знать, что экзотермические реакции идут с выделением теплоты, а эндотермические реакции с поглощением теплоты | Знание и понимание | 1 | 6 | КО | 3 | 2 | ||
| 8.3.1.5 -объяснять изменение энергии с точки зрения кинетической теории частиц | Навыки высокого порядка | 1 | 7 | РО | 4 | 3 | ||
| 8.2D Водород. Кислород и озон | 8.4.2.1 -уметь получать водород и изучать его свойства и применение | Применение | 2 | 8 9 | КО | 3 4 | 1 1 | 10 |
| 8.4.2.3 -уметь получать кислород и изучать его свойства и применение | Применение | 2 | 10 11 | КО/РО | 3 4 | 2 3 | ||
| 8.4.2.5 -объяснять значение озонового слоя Земли | Знание и понимание | 1 | 12 | КО | 4 | 3 | ||
| | Всего баллов | | | | | | | 25 |
Задания суммативного оценивания за 2 четверть по предмету «Химия»
-
В организме подростка содержится примерно 2. 1027 атомов кислорода. Рассчитайте, какое количество элемента кислорода содержится в теле подростка.
А) 30 моль
-
450 моль -
3322 моль -
330 моль
[1]
-
Горению этана (С2Н6) соответствует уравнение реакции: I. 2С2Н6 + 7О2 = 4СО2 + 6Н2О + Q
-
2С2Н6 + 5О2 = 4СО+ 6Н2О + Q -
2С2Н6 + 3О2 = 4С+ 6Н2О + Q А) верно только I
-
верно только I и II -
верно только I и III -
верно I - III
[1]
3(а) Рассчитайте, сколько стоит 1 моль поваренной соли (хлорида натрия NaCl), если 1кг стоит – 50 тенге.
Ответ:
(b) Рассчитайте, какое количество воды содержится в половине стакана (100 г).
Ответ:моль
[2]
-
Ученик на уроке провел ряд последовательных реакций:
20 г магния сжёг в кислороде и полученный оксид магния растворил в соляной кислоте.
Рассчитайте массу полученного продукта каждой реакции.
Mg → MgO → MgCl2

[4]
-
В таблице приведены результаты исследования некоторых газов.
| Наименование газа | Условия | Количество вещества | Объём |
| Озон | При нормальных условиях | 0,3 моль | У |
| Неон | При стандартных условиях | Х | 12 дм3 |
Определите значения Х и У. Х
У
[2]
-
На рисунке изображены две реакции, протекающие с изменением теплового эффекта. Определите тип реакции в каждой пробирке и приведите пример.
| Тип реакции по тепловому эффекту | №1: | №2: |
| Пример реакции | | |
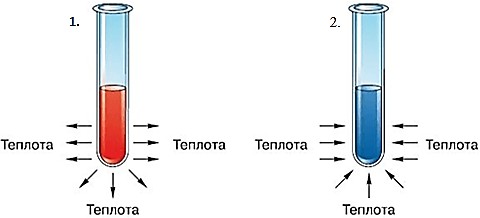
[2]
-
Изучите энергетические диаграммы получения и разложения воды.
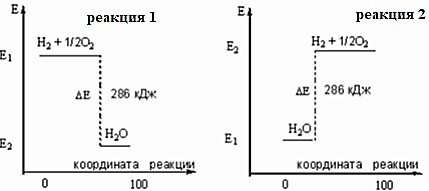
-
Назовите, какая из этих реакций протекает с выделением тепла.
Ответ:
[1]
-
Объясните изменение энергии с точки зрения кинетической теории частиц в данных реакциях:
реакция 1:


реакция 2:

[2]
-
В три сосуда собрали газообразные вещества, не имеющие вкуса, цвета и запаха:
водород,кислородиуглекислыйгаз. Сосуды закрыли стекляной платиной. Затем для каждого газа провели качественную реакцию, результаты которой изображены на рисунке:
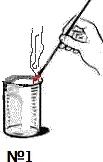 | 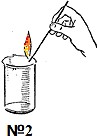 |  |
Определите газы в сосудах:
№1
№2
№3
-
Водород пропустили через нагретый оксид меди (ІІ):
[1]
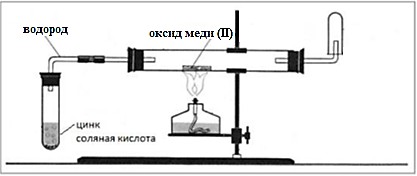
Запишите уравнение данной реакции и назовите свойство водорода (окислительное/восстановительное).
[1]
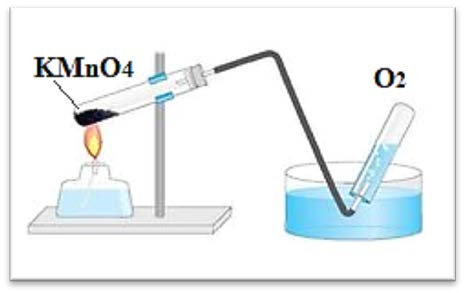 10(a) На рисунке изображен лабораторный способ получения кислорода разложением перманганата калия.
10(a) На рисунке изображен лабораторный способ получения кислорода разложением перманганата калия.Запишите название метода для собирания кислорода и объясните, на каком свойстве основан данный метод.
[1]
(b) Запишите уравнение данной рекции.
[1]
-
При разложении 39,5г перманганата калия выделился кислород, который полностью прореагировал с азотом, с образованием оксида азота (II) NO.
Рассчитайте массу оксида азота (II) NO.
[3]
-
Озоновый слой — часть стратосферы на высоте от 20 до 25 км, с наибольшим содержанием озона, образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2).
-
Напишите уравнение реакции образования озона.
[1]
-
Объясните значение озонового слоя.
[1]
-
Специалисты-экологи проявляют беспокойство в связи с тем, что в слое озона возникают
«дыры» - обширные области с пониженным содержанием озона.
Объясните, чем обусловлена опасность появления таких «дыр» для человека.
[1]
Схема выставления баллов
| № | Ответ | Балл | Дополнительная информация |
| 1 | C | 1 | |
| 2 | D | 1 | |
| 3(a) | 2925тенге | 1 | |
| 3(b) | 5,56 моль | 1 | |
| 4 | 2Mg + O2 = 2MgO и m (MgO) = 33.33г MgO + 2HCl = MgCl2 + 2H2O m = 79г | 1 1 1 1 | |
| 5 | Х – 6,72 л У – 0,5 моль | 1 1 | |
| 6 | №1 – экзотермическая, горение угля №2 – эндотермическая, разложение карбоната кальция | 1 1 | Принять любую верную реакцию |
| 7(а) | Реакция 1 | 1 | |
| 7(b) | Реакция 1 – количество теплоты, которое выделится при разрыве связей в исходных веществах гораздо больше, чем количество теплоты, затраченное на образование связей в продуктах реакции, поэтому избыточная теплота выделяется в окружающую среду. Реакция 2 – количество теплоты, затраченное на разрыв связей в исходном веществе гораздо меньше, чем количество теплоты, затраченное на образование новых связей, поэтому система поглощает энергию из вне. | 1 1 | |
| 8 | №1 – углекислый газ №2 – кислород №3 - водород | 1 | |
| 9 | CuO + H2 = Cu + H2O восстановительные свойства водорода | 1 | |
| 10(а) | Методом вытеснения воды, потому что кислород нерастворим в воде | 1 | |
| 10(b) | 2KMnO4 = K2MnO4 + MnO2 + O2 | 1 | |
| 11 | 2KMnO4 = K2MnO4 + MnO2 + O2 и O2 + N2 = 2NO | 1 | |
| m (O2) = 4 г | 1 | | |
| m (N2) = 7,5 г | 1 | | |
| 12(а) | 3О2 = 2О3 | 1 | |
| 12(b) | Озон, содержащийся в верхних слоях атмосферы, целиком поглощает особенно губительные коротковолновые ультрафиолетовые лучи, препятствуя тем самым повреждению живых систем. Определяет термический режим атмосферы | 1 | |
| 12(с) | Проникающее УФ излучение может вызывать
| 1 | |
| | Итого | 25 | |
