ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 17.10.2024
Просмотров: 32
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Модерация и выставление баллов
Все учителя используют одинаковую схему выставления баллов. В процессе модерации необходимо проверять образцы работ с выставленными баллами для того, чтобы не допускать отклонения от единой схемы выставления баллов.
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 1 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 1 четверть
Продолжительность - 40 минут
Количество баллов - 25
Типы заданий:
МВО – задания с множественным выбором ответов;
КО – задания, требующие краткого ответа;
РО – задания, требующие развернутого ответа.
Структура суммативного оценивания
Данный вариант состоит из 12 заданий, включающих задания с множественным выбором ответов, с кратким и развёрнутым ответами.
В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах, требующих развёрнутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Задание может содержать несколько структурных частей/подвопросов.
Характеристика заданий суммативного оценивания за 1 четверть
| Раздел | Проверяемые цели | Уровень мыслительных навыков | Кол. заданий* | № задания* | Тип задания* | Время на выполнение, мин* | Балл* | Балл за раздел |
| 8.1А Движение электронов в атомах | 8.1.3.1 -понимать, что электроны в атомах распределяются последовательно по энергетическим уровням на возрастающем расстоянии от ядра | Знание и понимание | 2 | 1,2 | МВО | 2 | 2 | 8 |
| 8.1.3.4 -уметь писать электронные конфигурации и электронно-графические формулы первых 20 химических элементов | Применение | 1 | 4 | РО | 4 | 2 | ||
| 8.1.3.5 -понимать, что атомы могут принимать или терять электроны, что приводит к образованию ионов | Знание и понимание | 1 | 3 | КО | 4 | 2 | ||
| 8.1.3.6 -составлять формулы соединений методом «нулевой суммы» | Применение | 1 | 5 | КО | 4 | 2 | ||
| 8.1В Формулы веществ и уравнения химически х реакций | 8.2.3.1 -вычислять массовые доли элементов в составе вещества, выводить формулы веществ по массовым долям элементов | Применение | 1 | 6 | РО | 6 | 4 | 8 |
| 8.2.3.3 -составлять уравнения химических реакций, записывая формулы реагентов и продуктов реакции | Применение | 1 | 7 | МВО | 4 | 2 | ||
| 8.2.2.1 -классифицировать химические реакции по числу и составу исходных и образующихся веществ | Знание и понимание | 2 | 8,9 | КО | 4 | 2 | ||
| 8.1С Сравнение активносте й металлов | 8.2.4.3 -исследовать факторы, влияющие на возникновение коррозии металлов | Навыки высокого порядка | 1 | 10 | РО | 4 | 3 | 9 |
| 8.2.2.5 -составлять уравнения реакций металлов с кислотами | Применение | 1 | 11 | КО | 4 | 3 | ||
| 8.2.4.8 -прогнозировать возможность протекания незнакомых реакций замещения металлов, используя ряд активности металлов | Навыки высокого порядка | 1 | 12 | РО | 4 | 3 | ||
| | Всего баллов | | | | | | | 25 |
Задания суммативного оценивания за 1 четверть по предмету «Химия»
-
Определите электронную формулу, соответствующую иону Cl-. А) 1s22s22p63s23p5
B) 1s22s22p63s23p6
C) 1s22s22p6
D) 1s22s22p63s23p4
[1]
-
Определите строку, в которой схема распределения электронов соответствует атому неона. А) Fо, 1s22s22p5
B) Na+, 1s22s22p63s1
C) Na+1, 1s22s22p6
D) Cl+5, 1s22s22p63s2
3(а) Элемент, который образует ион с зарядом Э-3, присоединяет электроны на третий энергетический уровень. Составьте формулу его соединения с водородом:
Ответ
[1]
3(b) Закончите схему образования иона Cl+7.
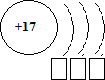
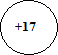
[1]
[1]
-
Напишите электронную и электронно – графическую формулы атома серы: Электронная формула:
Электронно – графическая формула:
 [2]
[2]-
Азот может образовывать пять оксидов разного состава. Составьте формулу оксида азота методом «нулевой суммы».-
y
N+5O
-
x
-
y
N+4O
x
6(a) Рассчитайте массовую долю азота в получившемся оксиде азота в задании 5(a).
[2]
[2]
(b) Выведите формулу оксида азота, если известно, что массовая доля азота в соединении составляет 63,64%, кислорода 36,36%.
[2]
-
Из предложенного перечня веществ выпишите необходимые формулы и закончите уравнения реакций:
H2SO3, CaCO3, C, NaCl, H2O, H2CO3, Na2SO3, KCl, H2SO4, SO2, NaH
2NaOH + …….. = Na2SO4 + 2……….
K2CO3 + 2HCl = 2………. + …………..
-
Определите и подпишите тип химической реакции.
[2]
| Химическая реакция | Тип реакции |
| PbO + SiO2 = PbSiO3 | |
| AgNO3 + KBr = AgBr + KNO3 | |
| 2KBr + Cl2 = 2KCl + Br2 | |
[1]
-
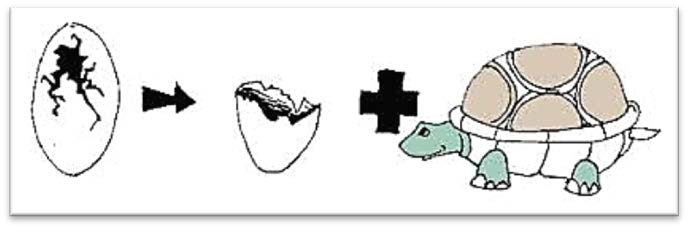 На рисунке изображен один из типов химической реакции:
На рисунке изображен один из типов химической реакции:
Приведите пример уравнения данного типа реакции:
[1]
-
На рисунке изображено исследование процесса коррозии. Железный гвоздь поместили в различную среду.
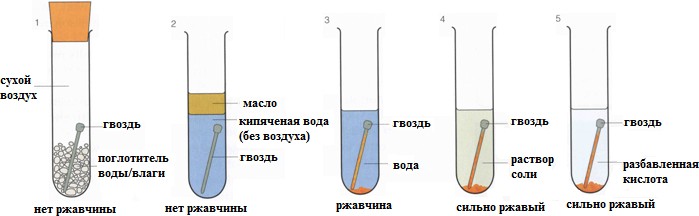
(а) Объясните, почему в пробирках 1-2 ржавчина не образуется.
[1]
(b) Объясните различия в пробирках 3 и 4-5 при образовании ржавчины.
[2]
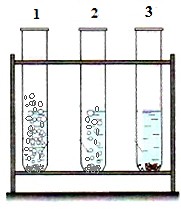 11(a) На рисунке изображены реакции взаимодействия металлов с кислотой:
11(a) На рисунке изображены реакции взаимодействия металлов с кислотой:Пробирка №1 – реакция протекает бурно, с быделением большого количества газообразного вещества;
Пробирка №2 – реакция протекает активно, наблюдается выделение газообразного вещества;
Пробирка №3 – протекание реакции не наблюдается.
Задание:
Предложите по одному примеру металлов для реакции в пробирках 1 и 2:
Пробирка №1
Пробирка №2 [1]
(b) Напишите уравнение реакции взаимодействия кислоты с предложенными вами металлами для пробирок № 1 и 2 в задании 11(a).
[2]
12. Для исследования активности металла
ученик поместил кобальт в разные растворы.
(а) Заполните таблицу, поставив «+» и «-» в соответствие с возможностью или отсутствием реакции:
| | AgNO3 | HCl | ZnSO4 | H2O(пар) |
| Со | | | | |
[1]
(b) Объясните причину подобного химического поведения кобальта.
[2]
Схема выставления баллов
| № | Ответ | Балл | Дополнительная информация | ||||||||||
| 1 | В | 1 | | ||||||||||
| 2 | С | 1 | | ||||||||||
| 3(а) | РН3 | 1 | | ||||||||||
| 3(b) | | 1 | | ||||||||||
| 4 | Электронная формула - 1s22s22p63s23p4 Электронографическая формула – 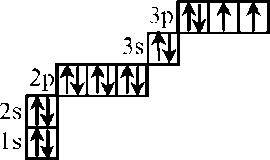 | 1 1 | | ||||||||||
| 5 |
| 1 1 | | ||||||||||
| 6(a) | Mr(N2O5) = 108 ɷ(N) = (28/108)x100% = 25,93% | 1 1 | | ||||||||||
| 6(b) | N:O = 63,64/14: 36,36/16 = 4,55:2,27 = 2:1 N2O | 1 1 | | ||||||||||
| 7 | 2NaOH + H2SO4 = Na2SO4 + 2H2O K2CO3 + 2HCl = 2KCl + H2CO3 | 1 1 | 1 за каждое верное уравнение | ||||||||||
| 8 | | Химическая реакция | Тип реакции | | 1 | 1 балл за 3 верных ответа | |||||||
| PbO + SiO2 = PbSiO3 | соединение | ||||||||||||
| AgNO3 + KBr = AgBr + KNO3 | обмен | ||||||||||||
| 2KBr + Cl2 = 2KCl + Br2 | замещение | ||||||||||||
| 9 | ???? Al(OH)3→ Al2O3 + H2O | 1 | Принять любое верное уравнение данного типа | ||||||||||
| 10 а) | В пробирках 1 и 2 железный гвоздь не подвергается коррозии, так как нет контакта с агрессивной средой, способствующей коррозии | 1 | | ||||||||||
| 10(b) | В пробирке №3 гвоздь контактирует с водой, которая является корродирующей средой; В пробирках № 4 и 5 гвоздь помещён в агрессивную среду раствора соли и кислоты, которые быстро разрушают железо | 1 1 | | ||||||||||
| 11(a) | Пробирка 1 – Zn Пробирка 2 - Fe | 1 | Пробирка №1 – все активные металлы, включая Al | ||||||||||
| 11(b) | Zn + 2HCl = ZnCl2 + H2 Fe + 2HCl = FeCl2 + H2 | 1 1 | Принять любое верно написанное уравнение | ||||||||||
| 12(a) | | | AgNO3 | HCl | ZnSO4 | H2O(пар) | | 1 | | ||||
| Со | + | + | - | + | |||||||||
| 12(b) | Кобальт реагирует с соляной кислотой, водой и нитратом серебра, т.к. в ряду активности Co стоит до Н. Кобальт не взаимодействует с сульфатом цинка, т.к. кобальт менее активен, чем цинк. | 1 1 | | ||||||||||
| | Итого | 25 | |||||||||||
