ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.02.2024
Просмотров: 72
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Свойства исходного сырья
Этилен (или этен) СН2 =СН2 - простейший алкен (олефин), ненасыщенное соединение. Представляет собой бесцветный горючий взрывоопасный газ со слабым запахом. [3]
Регистрационный номер CAS - 74-85-1. Физические свойства:
Т пл. = - 169,15°С, Т кип = - 103,71°С,
Т вспышки в воздухе = 136,1°С,
Т самовоспламенения в воздухе = 490°С. Молярная масса - 28,05 г/моль. Плотность ρ = 0,001178 г/см3.
Химические свойства: типичный представитель олефинов, обладает высокой реакционной способностью; нерастворим в воде, растворим в этаноле, хорошо растворим в диэтиловом эфире и углеводородах. В природе этилен практически не встречается.
Основной метод получения этилена - пиролиз жидких дистиллятов нефти или низших парафиновых углеводородов. В России, Западной Европе и Японии сырьём служит прямогонный бензин; выход этилена около 30% с одновременным образованием значительного количества жидких продуктов, в т. ч. ароматических углеводородов.
Этилен - самое производимое органическое соединение в мире. Общее мировое производство в 2005 г. составило 107 млн. т. и продолжает расти на 4
- 6% в год. [3]
Уксусная кислота (или этановая кислота) CH3COOH – слабая, предельная одноосновная карбоновая кислота. Является прозрачной жидкостью, с резким запахом и кислым вкусом.
Регистрационный номер CAS - 64-19-7.
Физические свойства:
Т пл. = 16,75°С,
Т кип = 181,1°С,
Т вспышки в воздухе = 38°С,
Т самовоспламенения в воздухе = 454°С. Молярная масса - 60,05 г/моль. Плотность ρ = 1,0492 г/см3.
Химические свойства: неограниченно растворима в воде, смешивается со многими растворителями. В уксусной кислоте хорошо растворимы органические соединения и газы.
Ранними промышленными методами уксусной кислоты были окисление ацетальдегида и бутана. Окисление ацетальдегида кислородом в присутствии ацетата марганца (II) при повышенной температуре и давлении:
2????????3???????????? + ????2 → CH3COOH
Выход уксусной кислоты составляет около 95%.
Окисление бутана при t=150-200°С и давлении 150атм в присутствии катализатора ацетата кобальта:
2????4????10 + 5????2 → 4????????3???????????????? + 2H2O
Оба эти методы базируются на окислении продуктов крекинга нефти. Но эти методы стали экономически не выгодными из-за повышения цен на нефть. За счет чего был создан новый метод получения уксусной кислоты путем каталитического карбонилирования метанола монооксидом углерода, который происходит, по уравнению:
????????????2
????????3???????? + ???????? → ????????3????????????????
- 1 2 3 4 5 6 7 8 9 10
Свойства винилацетата
Винилацетат (виниловый эфир уксусной кислоты) – это органическое соединение, относящееся к классу сложных эфиров. Представляет собой прозрачную жидкость с характерным запахом.
 Структурная формула:
Структурная формула:-
Физические свойства
Сам по себе винилацетат является бесцветной жидкостью легче воды. При охлаждении затвердевает. Плохо растворим в воде (2,5% от массы при температуре 20оС, а в мономере 0,1% от массы), но хорошо растворим в органических растворителях.
Т пл. = -93°С, Т кип = 72,7°С,
Т вспышки в воздухе = -5°С-8°С,

????
Т самовоспламенения в воздухе = 490°С Молярная масса = 28,05 г/моль Плотность ρ = 0,001178 г/см3 Вязкость (при 20 °С) = 0,432 спз Показатель преломления, ????20 = 1,3956
Диэлектрическая постоянная (при 25 °С) = 5,8 [4]
-
Химические свойства
При рассмотрении химических свойств винилацетата ярко проявляется природа виниловых эфиров. Может образовывать новые виниловые эфиры при взаимодействии с карбоновыми кислотами в присутствии солей Hg. По двойной связи может присоединять галогеноводородные соединения, водород, уксусную кислоту, а также вступает в диеновый синтез и подвергается карбонилированию. Помимо реакций присоединения по месту
двойной связи протекает гидролиз, который приводит к образованию ацетальдегида.
Гидролиз может осуществляться и
в кислой и в щелочной среде.
При проведении гидролиза в кислотной среде, изначально в реакцию вступает катион водорода, который образует промежуточные продукты. Затем при их разложении образуются кислота и виниловый спирт [5]
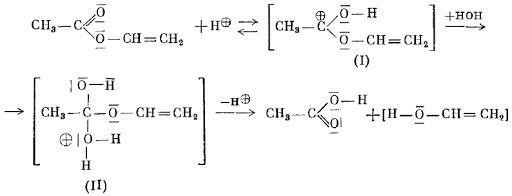
Рисунок 1 Кислотный гидролиз винилацетата
4
Если гидролиз осуществляется в щелочной среде, то после разложения промежуточных продуктов образуется анион уксусной кислоты и ацетальдегид. [5]
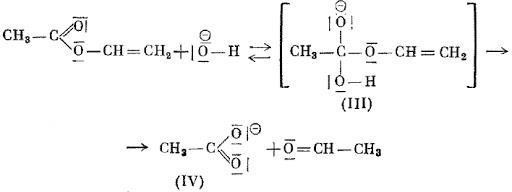
Рисунок 2 Щелочной гидролиз винилацетата
Одним из самых важных свойств внилацетата является его способность полимеризоваться и сополимеризоваться. Полимеризация происходит под действием света и радикальных инициаторов. Для предотвращения самопроизвольной полимеризации винилацетат ингибируют дифениламином, гидрохиноном, уксуснокислым триэтилбензиламмонием. Полимеризация протекает по ионному механизму в присутствии катализаторов – кислотными
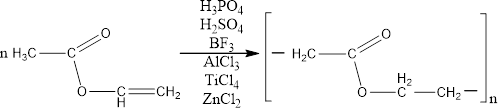 агентами. Среди них можно выделить протонные – НСlO4, Н3РО4, Н2SO4, CF3COOH и др., и апротонные (кислоты Льюиса) – BF3, SbCl5, SnCl4, А1С13, TiCl4, ZnCl2 и др. [4]
агентами. Среди них можно выделить протонные – НСlO4, Н3РО4, Н2SO4, CF3COOH и др., и апротонные (кислоты Льюиса) – BF3, SbCl5, SnCl4, А1С13, TiCl4, ZnCl2 и др. [4]Рисунок 3 Полимеризация винилацетата в присутствии катализаторов
2.3 Токсикологические свойства
Пары винилацетата обладают общетоксичным и наркотическим действием. Вещество относится к 3 классу опасности, а ПДК составляет 10 мг/м3.
Рабочие на производстве винилацетата жалуются на головную боль, повышенную утомляемость и раздражительность, нарушение сна. При стаже более 10 лет наблюдаются изменения в нервной системе.
При попадании эфира на открытые участки кожи наблюдается сильное раздражение, вплоть до омертвеления. Вдыхание паров может вызвать химический ожог дыхательных путей.
Также пары оказывают раздражающий эффект на слизистую оболочку глаз. При поступлении в организм быстро расщепляется на уксусную кислоту и виниловый спирт. Последний моментально изомеризуется в ацетальдегид.
-
Методы получения винилацетата
Как было указано выше, производство винил ацетата осуществляется двумя способами: из ацетилена и уксусной кислоты и окислением этилена в присутствии уксусной кислоты. Оба способа можно проводить двумя методами: парофазным и жидкофазным.
-
Получение винилацетата из ацетилена и уксусной кислоты
Уравнение получения винилацетата из ацетилена и уксусной кислоты: CH≡CH + CH3COOH → CH2=CH–OCOCH3
-
Парофазный метод
Производство винилацетата в паровой фазе впервые произошло в 1928г. в Германии. Это один из самых старых промышленных методов получения винилацетата.
Реакция получения протекает в присутствии катализатора, в роли которого выступает ацетат цинка

