Файл: Отчет по лабораторной работе По дисциплине Термодинамика и кинетика.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 13
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ ВЫСШЕГО ОБРАЗОВАНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей и физической химии
Отчет по лабораторной работе
По дисциплине Термодинамика и кинетика
(наименование учебной дисциплины согласно учебному плану)
Тема работы: Молекулярная адсорбция на активированном угле
Выполнил: студент гр. ГНГ-21-1 Филимонова А.А.
(шифр группы) (подпись) (Ф.И.О.)
Дата:
Проверил:
(должность) (подпись) (Ф.И.О)
Санкт-Петербург
2023 г.
-
Цель работы
Рассчитать значение концентрации раствора кислоты, взятой на проведение адсорбции, вычислить значения удельной адсорбции растворенного вещества.
-
Ход эксперимента
Отобрали в химический стакан объемом 150 мл порцию муравьиной кислоты.
Приготовили 4 раствора путем последовательного разведения (дистиллированной водой) в 2 раза
В каждую колбу с приготовленными растворами высыпали по навеске 3 г активированного угля.
Колбы поставили на перемешивающее устройство на 15 минут.
Осторожно слили растворы через бумажный фильтр в конические колбы
Чтобы определить концентрацию кислоты в исходном С0 и равновесных С* растворах, в 2 конические колбы мерной пипеткой отобрали по 5 мл пробы, затем в каждую колбу добавить немного дистиллированной воды.
Затем в каждую колбу прилили по 3-4 капель индикатора – фенолфталеина и, залив в бюретку щёлочь (NaOH), титровали колбы с растворами, постоянно помешивая, до перехода окраски фенолфталеина от бесцветной к малиновой.
Полученное значение объема щелочи занесли в таблицу 2 протокола лабораторной работы.
Довели объем щелочи в бюретке до отметки «0» и провели повторное титрование пробы во второй конической колбе.
Полученное значение объема щелочи занесли в таблицу 2 протокола лабораторной работы.
-
Экспериментальные данные
Таблица 1 – Содержание протокола лабораторной работы
| Масса навески угля ms, г | 3 |
| Концентрация раствора щелочи С(NaOH), экв/л | 0,1 |
| Слабый электролит | HCOOH |
| Ориентировочная концентрация слабого электролита, моль/л | 0,4 |
| Объем аликвоты Va, мл | 5 |
Таблица 2 – Результаты анализа проб кислоты
| № пробы | Концентрация | V(а), мл | V1(NaOH), мл | V2(NaOH), мл | Vср(NaOH), мл |
| Исходная | С0 | 5 | 20,3 | 20,3 | 20,3 |
| 1 | С0 | 5 | 16,5 | 16,4 | 16,45 |
| 2 | С0/2 | 5 | 8,3 | 8,1 | 8,2 |
| 3 | С0/4 | 5 | 4,1 | 4,3 | 4,2 |
| 4 | С0/8 | 5 | 2,0 | 2,1 | 2,05 |
-
Обработка результатов эксперимента
-
Концентрация раствора кислоты, взятого на приготовление растворов и проведение адсорбции:
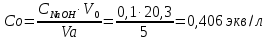
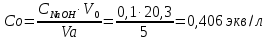
где V0 – средний объем гидроксида натрия, затраченный на титрование пробы исходной кислоты, мл.
-
Равновесные концентраций кислоты:
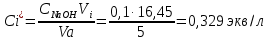
где Vi – средний объем гидроксида натрия, затраченный на титрование пробы кислоты после адсорбции, мл.
-
Изменение концентрации кислоты в процессе адсорбции: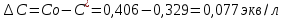
-
Удельная адсорбция растворенного вещества Г:
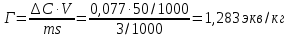
где V – объем кислоты, взятый на адсорбцию, л; ms – навеска адсорбента (активированного угля), кг.
Таблица 3 - Данные для построения изотерм адсорбции
| № | Концентрация | С, экв/л | Г, экв/кг | С*/Г | lgC* | lgГ | 1/C* | 1/Г | |
| раствора, экв/л | |||||||||
| С0 | С* | ||||||||
| 1 | 0,406 | 0,329 | 0,077 | 1,283 | 0,422 | -0,483 | 0,108 | 3,040 | 0,779 |
| 2 | 0,203 | 0,164 | 0,039 | 0,650 | 0,107 | -0,785 | -0,187 | 6,098 | 1,538 |
| 3 | 0,101 | 0,078 | 0,023 | 0,383 | 0,030 | -1,108 | -0,417 | 12,821 | 2,611 |
| 4 | 0,051 | 0,041 | 0,010 | 0,167 | 0,007 | -1,387 | -0,777 | 24,390 | 5,988 |
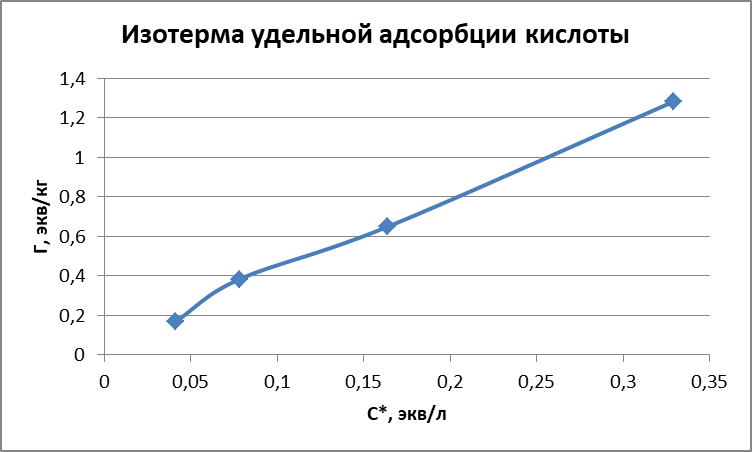
Рисунок 1 - Изотерма удельной адсорбции
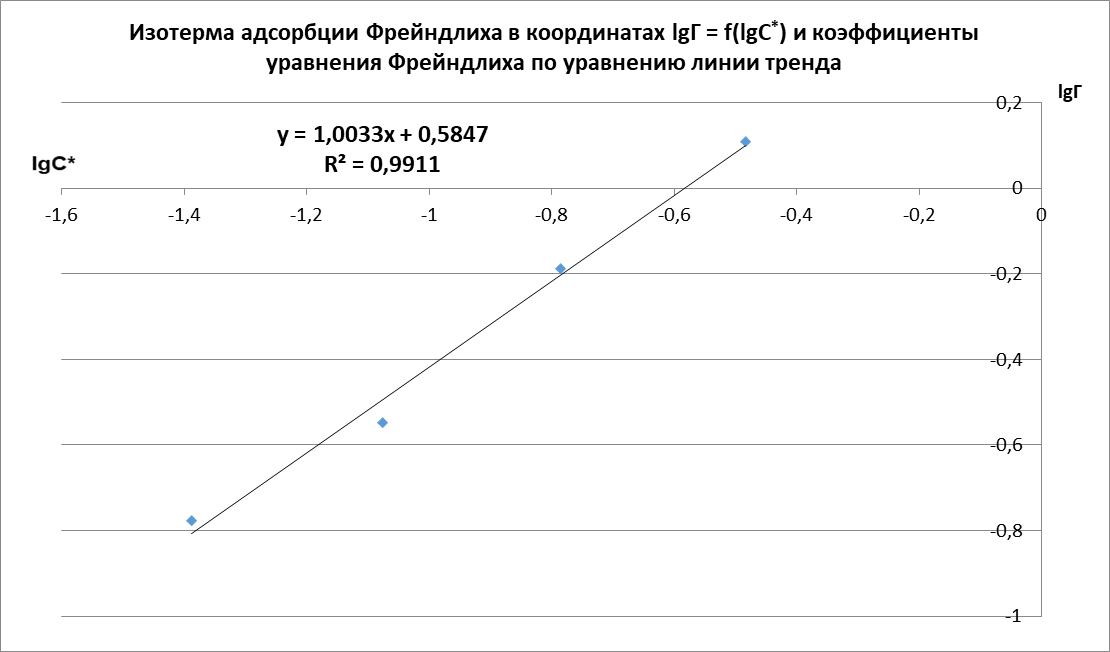
Рисунок 2 – Линейная форма уравнения адсорбции Фрейндлиха lgK = 0,5847 1/n = 1,0033
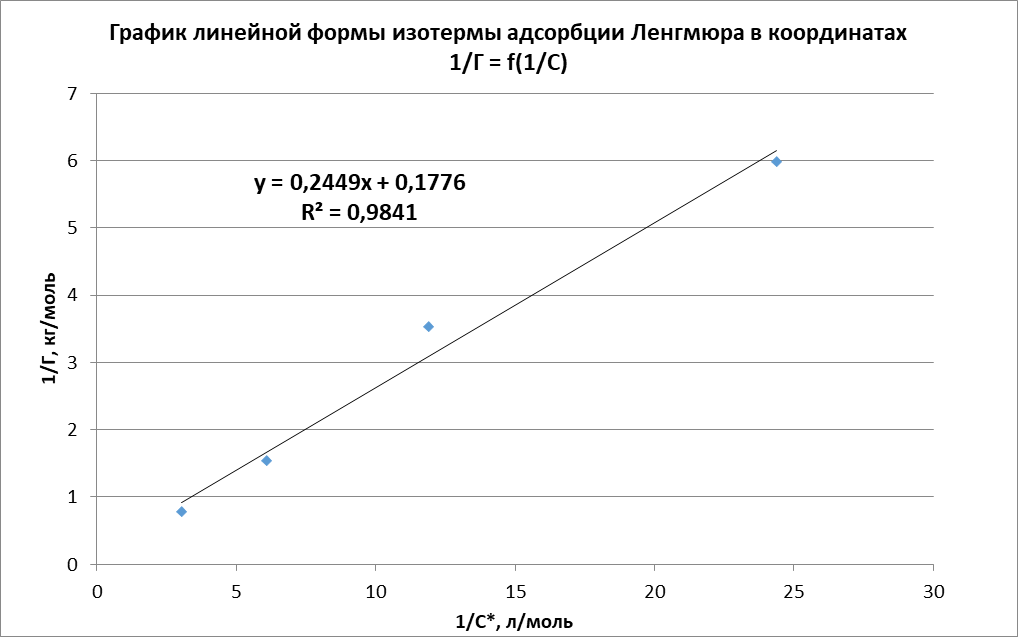
Рисунок 3 - Линейная форма уравнения адсорбции Ленгмюра в координатах 1/Г = f(1/C)
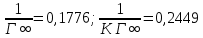
-
Константа уравнения Ленгмюра Г∞:
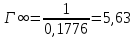
-
Удельная поверхность активированного угля:
Sо=Г∞
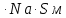 =
= 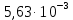
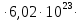 20,51020 = 695 м2/г
20,51020 = 695 м2/ггде NA – число Авогадро; SM – площадь поперечного сечения молекулы адсорбата, равная для карбоновых кислот 20,51020 м2.
-
Вывод
В ходе лабораторной работы была определена концентрация раствора кислоты, взятой на проведение адсорбции, она составила
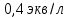 . Концетрация опредена правильно, так как теоретические значение концентрации муравьиной кислоты 0,4 экв/л.
. Концетрация опредена правильно, так как теоретические значение концентрации муравьиной кислоты 0,4 экв/л. Также были построены изотермы адсорбции, проверена применимость к ним уравнений Фрейндлиха и Ленгмюра, определены постоянные, входящие в них (
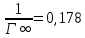 ;
;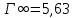 ) и удельная поверхность активированного угля Sо= 695 м2/г, что входит в теоретические рамки удельной поверхности активированного угля (от 300 до 1000 м2/г).
) и удельная поверхность активированного угля Sо= 695 м2/г, что входит в теоретические рамки удельной поверхности активированного угля (от 300 до 1000 м2/г).


