ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.02.2024
Просмотров: 179
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Бағдарламаның ерекшелігі Қазақстан Республикасының жалпы білім беру мемлекеттік стандартында көзделген әрбір оқыту ерекшеліктеріне қарай оқыту технологиялары іріктеліп алынған.
Жалпы көлемі – 78 сағат, оның – 48 сағат теориялық, 30 сағат-практикалық.
Химия пәнінің тақырыптық жоспар
| сабақ | Сабақ тақырыбы | сағат | |
| теория | практика | ||
| | I. Атом құрылысы теориясы тұрғысынан периодтық заң,химиялық байланыс және зат құрылысы | | |
| 1 | Атом құрылысы теориясы тұрғысынан периодтық заң және периодтық жүйесі. Химиялық элементтер, атомдар, молекула және олардың сипаттамалары | 2 | |
| 2 | Элементтердің қасиеттері периодтылығының мәні.Д.И.Менделеев ашқан периодтық заңның және атом құрылысы теориясының маңызы | 2 | |
| 3 | Химиялық байланыс. Ковалентті байланыс.Иондық байланыс және металдық байланыс. Сутектік байланыс және кристалдық торлардың типтері | 1 | 1 |
| 4 | Бақылау жұмысы №1 | | 2 |
| | II. Бейорганикалық заттардың негізгі кластары.Химиялық реакциялар және олардың жүру заңдылықтары | | |
| 5 | Бейорганикалық қосылыстар және олардың жіктелуі. Оксидтер. Қышқылдар мен негіздер. Негіздердің құрамы, жіктелуі, химиялық қасиеттері. Тұздардың құрамы,жіктелуі, алынуы. | 1 | 1 |
| 6 | Химиялық реакциялар және олардың жіктелуі. Тотығу-тотықсыздану реакциялары. | | 2 |
| 7 | Тұздар гидролизі | 1 | 1 |
| 8 | Химиялық реакцияның жылдамдығы | 1 | 1 |
| 9 | Химиялық тепе-теңдік | | 2 |
| | IІІ. Металдар мен бейметалдарға сипаттама | | |
| 10 | Металдардың периодтық жүйедегі орны және атом құрылысының ерекшеліктері. Бейметалдардың жалпы сипаттамасы | 2 | |
| 11 | Металдардың электрохимиялық кернеу қатары. Металдардың химиялық қасиеттері. Тірі ағзалар үшін металдардың маңызы | 2 | |
| | ІV. Маңызды s-, p элементтер және олардың қосылыстары | | |
| 12 | І А топша элементтері. Жалпы сипаттама. Натрий | 2 | |
| 13 | ІІ А топша элементтері. Кальций. Судың кермектігі. | 1 | 1 |
| 14 | p-элементтерге жалпы сипаттама. Алюминий. | 2 | |
| 15 | ІV А топша элементтеріне жалпы сипаттама . Көміртек. Кремний. V А топша элементтеріне жалпы сипаттамасы.Азот. Азоттың маңызды қосылыстары. Фосфор. | 1 | 1 |
| 16 | VІ А топша элементтерінің жалпы сипаттамасы. Күкірт. VІІ А топша элементтерінің жалпы сипаттамасы. Хлор. | 2 | |
| | V. d-элементтердің жалпы сипаттамасы | | |
| 17 | d-элементтердің периодтық жүйесіндегі орны, атом құрылысы ерекшеліктері. Мыс. Мырыш. | 2 | |
| 18 | Темір. Металдардың жемірілуі. | 2 | |
| 19 | Бақылау жұмысы №2 | | 2 |
| | ІІ семестр | | |
| | І . Органикалық заттар-көміртек қосылыстары. | | |
| 1 | Органикалық заттардың химиялық құрылыс теориясы. Көмірсутектердегі химиялық байланыстардың электрондық теориясы. | 2 | |
| 2 | Органикалық қосылыстардағы химиялық байланыстар. Органикалық қосылыстарды атаудың негіздері. Гомологтар мен изомерлер. | 2 | |
| 3 | Зертханалық жұмыс № 1. Органикалық заттардың сапалық құрамын анықтау. | | 2 |
| 4 | Бақылау жұмысы № 3. Органикалық заттар-көміртек қосылыстар. | | 2 |
| | ІІ. Көмірсутектер мен олардың табиғи көздері. | | |
| 5 | Қаныққан көмірсутектер. Алкандар мен циклоалкандар | 2 | |
| 6 | Қанықпаған көмірсутектер. Алкендер немесе этиленді көмірсутектер | | 2 |
| 7 | Диен көмірсутектері. Ацетилен көмірсутектер немесе алкиндер. | 2 | |
| 8 | Ароматты көмірсутектер (арендер). Бензол, толуол. | | 2 |
| 9 | Көмірсутектің табиғи көздері. Кокстеу өндірісі. | 2 | |
| 10 | Мұнай. Мұнай құрамы, қасиеттері және алынатын өнімдері. Қазақстандағы көмірсутекті кең орындары және оларды пайдалану. | 2 | |
| 11 | Бақылау жұмысы № 4 | | 2 |
| | ІІІ. Оттекті органикалық қосылыстар | | |
| 12 | Бір атомды қаныққан спирттер және жай эфирлер. | 2 | |
| 13 | Көп атомды спирттер. | | 2 |
| 14 | Фенолдар.Альдегидтер мен кетондар. Карбон қышқылдары. | 2 | |
| 15 | Күрделі эфирлер. Майлар.Көмірсулар. Дисахаридтер. Сахароза. Крахмал. | 2 | |
| 16 | Целлюлоза. Ацеттаты талшық. Көмірсутектер мен оттекті органикалық қосылыстар арасындағы генетикалық байланыстар. | 2 | |
| 17 | Зертханалық жұмыс № 2. Органикалық заттарды танып білуге арналған эксперименттік есептерді шешу. | | 2 |
| | ІV. Азотты органикалық қосылыстар | | |
| 18 | Аминдер. Аминқышқылдары. Құрамында азоты бар гетероциклді қосылыстар. | 2 | |
| 19 | Белоктар. Нуклеин қышқылы. Тірі организмдердің химиялық құрамы. Витаминдер. | 2 | |
| 20 | Бақылау жұмысы № 4 | | 2 |
Глоссарий
Атом – химиялық элементтің барлық химиялық қасиеттерін сақтай алатын ең кіші бөлшек.
Байланыс энергиясы – бұл байланысты үзуге жұмсалатын энергия.
Валенттілік - дегеніміз элемент атомының химиялық байланыс түзу қабілеті.
Гомогенді жүйе –бір фазадан тұратын система.
Гетерогенді жүйе –әр түрлі фазалардан тұратын система.
Дисперсті орта -ұсақталған күйдегі заты бар орта.
Ерітінді – екі не одан да көп компоненттен тұратын гомогенді жүйелер.
Жай зат – молекулалары бір элементтің атомдарынан тұратын заттар.
Зольдер - коллоидты жүйедегі дисперсті фаза бөлшектері қатты күйде, ал орта сұйық күйде болатын ерітінділер.
Изотоптар – ядро зарядтары бірдей, ал массалық сандары әр түрлі болатын атомдардың түрлері.
Қышқыл – сулы ерітінділерде гидроксоний (Н3О+) ионын түзетін электролит.
Катод –теріс зарядты электрод.
Молекула – заттың химиялық қасиетін көрсететін ең кіші бөлшек.
Молярлық масса – заттың 1 моль мөлшерінің массасы.
Негіз – сулы ерітіндіде диссоциацияланғанда ОН- ионын түзеді.
Период – ядро зарядының біртіндеп өсуі және қасиеттерінің белгілі тәртіп бойынша өзгеру ретімен орналасқан элементтер жиынтығы.
Салыстырмалы атомдық масса – табиғи изотоптық құрамы бар элемент атомының орташа массасының 12С көміртегі атомының 1/12 массасына қатынасы.
Топ – жоғары оң валенттілігі бірдей элементтердің жиынтығы.
Тұздар – электролиттік диссоциация кезінде металл катионын және қышқыл қалдығы анионын түзетін электролиттер.
Физикалық құбылыстар – заттардың агрегаттық күйі мен пішінінің өзгеруі.
Химия – заттардың құрамын, құрылысын, қасиеттерін, химиялық өзгерістерін, өзгеріс жағдайын, әрі өзгерістермен қабат болатын құбылыстарды зерттейтін ғылым.
Химиялық кинетика – химиялық процестердің барысын уақытпен бағалап зерттейтін бөлім.
Химиялық коррозия – металдардың ауадағы оттегімен немесе басқа газдармен әрекеттесіп тотығуы.
Химиялық формулалар - күрделі заттардың құрамын көрсетеді.
Элементтің химиялық таңбасы – элементтің атын, оның бір атомын, атомының массасын көрсетеді.
Пәннің тақырыптық-күнтізбелік жоспары
| № | Тараулар мен тақырыптар атауы | сағаты | Өткізу мерзімі | ||
| Теория | Практика | ||||
| | І семестр 19 апта, аптасына 2 сағат барлығы 38 сағат | | |||
| | I. Атом құрылысы теориясы тұрғысынан периодтық заң,химиялық байланыс және зат құрылысы | | |||
| 1 | Атом құрылысы теориясы тұрғысынан периодтық заң және периодтық жүйесі. Химиялық элементтер, атомдар, молекула және олардың сипаттамалары | 2 | | | |
| 2 | Элементтердің қасиеттері периодтылығының мәні.Д.И.Менделеев ашқан периодтық заңның және атом құрылысы теориясының маңызы | 2 | | | |
| 3 | Химиялық байланыс. Ковалентті байланыс.Иондық байланыс және металдық байланыс. Сутектік байланыс және кристалдық торлардың типтері | 1 | 1 | | |
| 4 | Бақылау жұмысы №1 | | 2 | | |
| | II. Бейорганикалық заттардың негізгі кластары. Химиялық реакциялар және олардың жүру заңдылықтары | | |||
| 5 | Бейорганикалық қосылыстар және олардың жіктелуі. Оксидтер. Қышқылдар мен негіздер. Негіздердің құрамы, жіктелуі, химиялық қасиеттері. Тұздардың құрамы,жіктелуі, алынуы. | 1 | 1 | | |
| 6 | Химиялық реакциялар және олардың жіктелуі. Тотығу-тотықсыздану реакциялары. | | 2 | | |
| 7 | Тұздар гидролизі | 1 | 1 | | |
| 8 | Химиялық реакцияның жылдамдығы | 1 | 1 | | |
| 9 | Химиялық тепе-теңдік | | 2 | | |
| | IІІ. Металдар мен бейметалдарға сипаттама | | |||
| 10 | Металдардың периодтық жүйедегі орны және атом құрылысының ерекшеліктері. Бейметалдардың жалпы сипаттамасы | 2 | | | |
| 11 | Металдардың электрохимиялық кернеу қатары. Металдардың химиялық қасиеттері. Тірі ағзалар үшін металдардың маңызы | 2 | | | |
| | ІV. Маңызды s-, p элементтер және олардың қосылыстары | | |||
| 12 | І А топша элементтері. Жалпы сипаттама. Натрий | 2 | | | |
| 13 | ІІ А топша элементтері. Кальций. Судың кермектігі. | 1 | 1 | | |
| 14 | p-элементтерге жалпы сипаттама. Алюминий. | 2 | | | |
| 15 | ІV А топша элементтеріне жалпы сипаттама . Көміртек. Кремний. V А топша элементтеріне жалпы сипаттамасы.Азот. Азоттың маңызды қосылыстары. Фосфор. | 1 | 1 | | |
| 16 | VІ А топша элементтерінің жалпы сипаттамасы. Күкірт. VІІ А топша элементтерінің жалпы сипаттамасы. Хлор. | 2 | | | |
| | V. d-элементтердің жалпы сипаттамасы | | |||
| 17 | d-элементтердің периодтық жүйесіндегі орны, атом құрылысы ерекшеліктері. Мыс. Мырыш. | 2 | | | |
| 18 | Темір. Металдардың жемірілуі. | 2 | | | |
| 19 | Бақылау жұмысы №2 | | 2 | | |
| | ІІ семестр 20 апта, аптасына 2 сағат 40 сағат | | |||
| | І . Органикалық заттар-көміртек қосылыстары. | | |||
| 1 | Органикалық заттардың химиялық құрылыс теориясы. Көмірсутектердегі химиялық байланыстардың электрондық теориясы. | 2 | | | |
| 2 | Органикалық қосылыстардағы химиялық байланыстар. Органикалық қосылыстарды атаудың негіздері. Гомологтар мен изомерлер. | 2 | | | |
| 3 | Зертханалық жұмыс № 1. Органикалық заттардың сапалық құрамын анықтау. | | 2 | | |
| 4 | Бақылау жұмысы № 3. Органикалық заттар-көміртек қосылыстар. | | 2 | | |
| | ІІ. Көмірсутектер мен олардың табиғи көздері. | | |||
| 5 | Қаныққан көмірсутектер. Алкандар мен циклоалкандар | 2 | | | |
| 6 | Қанықпаған көмірсутектер. Алкендер немесе этиленді көмірсутектер | | 2 | | |
| 7 | Диен көмірсутектері. Ацетилен көмірсутектер немесе алкиндер. | 2 | | | |
| 8 | Ароматты көмірсутектер (арендер). Бензол, толуол. | | 2 | | |
| 9 | Көмірсутектің табиғи көздері. Кокстеу өндірісі. | 2 | | | |
| 10 | Мұнай. Мұнай құрамы, қасиеттері және алынатын өнімдері. Қазақстандағы көмірсутекті кең орындары және оларды пайдалану. | 2 | | | |
| 11 | Бақылау жұмысы № 4 | | 2 | | |
| | ІІІ. Оттекті органикалық қосылыстар | | |||
| 12 | Бір атомды қаныққан спирттер және жай эфирлер. | 2 | | | |
| 13 | Көп атомды спирттер. | | 2 | | |
| 14 | Фенолдар.Альдегидтер мен кетондар. Карбон қышқылдары. | 2 | | | |
| 15 | Күрделі эфирлер. Майлар.Көмірсулар. Дисахаридтер. Сахароза. Крахмал. | 2 | | | |
| 16 | Целлюлоза. Ацеттаты талшық. Көмірсутектер мен оттекті органикалық қосылыстар арасындағы генетикалық байланыстар. | 2 | | | |
| 17 | Зертханалық жұмыс № 2 Органикалық заттарды танып білуге арналған эксперименттік есептерді шешу. | | 2 | | |
| | ІV. Азотты органикалық қосылыстар | | |||
| 18 | Аминдер. Аминқышқылдары. Құрамында азоты бар гетероциклді қосылыстар. | 2 | | | |
| 19 | Белоктар. Нуклеин қышқылы. Тірі организмдердің химиялық құрамы. Витаминдер. | 2 | | | |
| 20 | Бақылау жұмысы № 4 | | 2 | | |
Дәріс: 1
Тақырыбы: Атом құрылысы теориясы тұрғысынан периодтық заң және периодтық жүйесі. Химиялық элементтер, атомдар, молекула және олардың сипаттамалары.
Мақсаты: Пәннің міндеттерімен, құрылымымен танысу, химияның негізгі зандарымен және ұғымдарымен танысып біледі.
Жоспары:
1. Химияның негізгі ұғымдары.
2. Химияның негізгі стехиометриялық зандары.
-
3.Салыстырмалы атомдық массаны, салыстырмалы молярлық массаны анықтау әдістері. -
Атом химиялық қосылыстардағы элементтердің ең кіші бөлшегі. Атом дегеніміз – оң зарядты ядродан және саны сол оң зарядтарды теңгеретін электрондардан тұратын нейтрал бөлшек. Молекула дегеніміз - осы заттың химиялық қасиеттерін сақтап тұратын ең кіші бөлшегі. Молекулалары бір элементтің атомдарынан тұратын заттарды –жай заттар дейміз. Жай заттарға H2, CL2, Na, O2 , N2 т. б. жатады. Бір элементтің бірнеше жай заттар түзуін аллотропиялық құбылыс дейді. Молекулалары әртүрлі элементтің атомдарынан тұратын заттарды – күрделі заттар дейді. Мысалы; CuO,H2SO4. Күрделі заттарға барлық оксидтер, қышқылдар, негіздер, тұздар және толып жатқан органикалық қосылыстар мысал бола алады. Атомның ең маңызды көрсеткіштерінің бірі оның массасы. Атомдардың шамасы өте кішкентай шама. Мысалы: сутек атомының массасы 1,67*10-27 кг, оттектікі 26,60*10-27кг көміртегі 19,93*10-27. -
Сондықтан атомдардың салыстырмалы массаларын пайдаланады.
1961ж. халықаралық келісім бойынша массаның атомдық бірлігі ретінде атомдық массасы 12–ге тең көміртек изотопы массасының1/12 бөлігі қабылданды. Көміртек (С-12) атомы массасының 1/12 бөлігі массасының атомдық бірлігі (м.а.б) деп аталады. 1 массаның атомдық бірлігі (1а.м.б.) 1,66* 10-27 кг тең.
-
Ar(O)=26,60*10-27/1,66*10-27= 16; -
Ar(H)= 1,67*10-27/1,66*10-27=1; -
Ar(C)=19,93*10-27 / 1,66*10-27=12. -
Салыстырмалы атомдық масса дегеніміз сол элемент атомы массасының көміртек атомы массасыныкі 1/12 бөлігінен немесе массасының атомдық бірлігінен неше есе ауыр екенін көрсететін сан. Салыстырмалы молекулалық масса дегеніміз сол зат молекуласы массасының 1 массасының атомдық бірлігінен неше есе ауыр екенін көрсететін сан. Салыстырмалы молекулалық массаны (Mr) табу үшін молекула құрамына кіретін барлық атомдардың массаларын қосу керек. -
Mr (Al2(SO4)3 = 27*2+32*3+16*12=342. -
Осыған сәйкес молекулалық массасы 342*1 м.а.б. =342 м.а.б. Моль –зат мөлшерінің өлшемі. Моль деп көміртек изотопының (12С) 0,012 килограмында қанша атомдар болса, құрамында сонша құрылыстық бірліктері (атомдар, молекулалар, иондар) болатын заттың мөлшерін айтады. Көміртектің 0,012 кг-да 6,02*1023 атомдар болатынын зерттеулер анықталған. Заттың 1 молінде 6,02*1023 бөлшек болады. Бұл санды Авогадро саны деп атайды. Заттың 1 моль мөлшерінің массасы молярлық масса деп аталады, оны г/моль немесе кг/моль көрсетеді. Сонымен, моль – бұл 0,012 кг көміртегі 12С изотопында болатын атомдар санына тең құрылымдық бірліктер (молекулалар, атомдар,иондар,электрондар,) болатын заттың мөлшері. -
Атом-молекулалық ілімнің негізгі қағидалары (1741 ж., М.Ломоносов): -
1. Заттар молекулалардан тұрады. Әр түрлі заттардың молекулаларының химиялық құрамы, физикалық және химиялық қасиеттері әр түрлі болады. -
2. Молекулалар әрқашанда қозғалыста болады. Олар бір-біріне тартылады және бір-бірінен тебіледі. Молекулалардың қозғалыс жылдамдығы заттардың агрегаттық күйіне тәуелді. -
3. Физикалық құбылыс болғанда, молекулалардың құрамы өзгермейді, ал химиялық құбылыстарда молекулалар сапалық жағынан да өзгереді, олардан басқа молекулалар түзіледі. -
4. Молекулалар атомдардан тұрады. Атомдардың өзіндік өлшемі, массасы болады. -
5. Бір элементтің атомдарының қасиеттері бірдей, ал басқа элементтің атомдарының қасиеттері өзгеше болады. Химиялық реакция жүрген кезде, молекулалар өзгереді, ал атомдар өзгермейді. -
6. Атом жай және күрделі заттардың молекулаларының құрамына кіретін химиялық элементтердің ең кіші бөлшегі. Молекула заттың химиялық қасиетін сақтайтын ең кішкене бөлшегі. Молекулалар әр түрлі атомдардан және тек бірдей атомдардан тұра алады. -
-
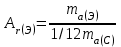 ;
; 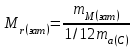
-
мұндағы Аr - элементтің салыстырмалы атомдық массасы; -
Мr – заттың салыстырмалы молекулалық массасы; -
ma(Э) – элемент атомының массасы, г; -
ma(С) – көміртегі атомының массасы, г; -
mм(зат) – заттың молекуласының массасы, г. -
-
Қазіргі өлшемдердің халықаралық жүйесінде заттың мөлшерінің өлшемі ретінде моль қабылданған Моль (ν)деп көміртек изотопының (12С) 0,012 кг қанша атомдар болса, құрамында сонша құрылыстық бірліктері (атомдар, молекулалар, иондар) болатын заттың мөлшерін айтады. -
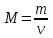 ; М = Мr , г/моль;
; М = Мr , г/моль; 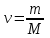 ;
; 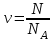 ;
; 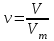 ;
; -
мұндағы: М – молярлық масса, г/моль; -
m – зат массасы, г; -
N – бөлшектердің саны; -
NA – Авогадро саны, NA = 6.02*1023 моль –1, -
V – қ.ж. газдың көлемі, л; -
Vm – молярлық көлем, Vm = 22,4 л/моль.


