Файл: Целью обучения химии является целостное формирование системы химических знаний и естественнонаучного представления об окружающем мире, развитие функционально грамотной и творческой личности.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 6
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Целью обучения химии является целостное формирование системы химических знаний и естественнонаучного представления об окружающем мире, развитие функционально грамотной и творческой личности.
Термин «функциональная грамотность» был введен в 1957 году ЮНЕСКО, наряду с понятиями «грамотность» и «минимальная грамотность». Формирование функциональной грамотности – сложный, многосторонний, длительный процесс. Достичь нужных результатов можно лишь умело, грамотно сочетая в своей работе различные современные образовательные педагогические технологии. Функциональная грамотность – степень подготовленности человека к выполнению возложенных на него или добровольно взятых на себя функций.
Обучение учащихся процессу самостоятельной добычи, анализа, структурирования и эффективного использования информации для максимальной самореализации и полезного участия в жизни общества, выступает ведущим направлением процесса модернизации системы образования.
В этих условиях роль предметов, в частности химии, биологии, имеющих множество «пограничных» с другими дисциплинами областей исследования возрастает в старших классах школ и обеспечивает разработку эффективных путей и средств решения, жизненно важных для людей задач и проблем (защита окружающей среды, здравоохранение, агроэкология и другие). Ядром данного процесса выступает функциональная грамотность, так как под ней понимают «способность человека решать стандартные жизненные задачи в различных сферах жизни и деятельности на основе прикладных знаний».
Естественнонаучная грамотность – способность использовать естественнонаучные знания, выявлять проблемы и делать обоснованные выводы, необходимые для понимания окружающего мира и тех изменений, которые вносит в него деятельность человека, а также для принятия соответствующих решений.
Функциональная грамотность как результат обучения формируется посредством каждого школьного предмета. Инструментарием развития функциональной грамотности школьников, а также проверки ее сформированности, являются задания творческого характера и интегративные задания.
З
 адание 1. Две хозяйки готовились к стирке. Первая подогрела воду до 60 градусов и замочила в ней белье, вторая нагрела воду до кипения, прокипятила ее 5 минут, а затем охладила до 60 градусов и только после этого начала стирку. У кого белье лучше отстирается? Объясните и докажите.
адание 1. Две хозяйки готовились к стирке. Первая подогрела воду до 60 градусов и замочила в ней белье, вторая нагрела воду до кипения, прокипятила ее 5 минут, а затем охладила до 60 градусов и только после этого начала стирку. У кого белье лучше отстирается? Объясните и докажите.Ответ:
Объяснение
Мыло и другие моющие средства намного эффективнее действуют в мягкой воде. Жесткость воды обусловлена наличием в ней гидрокарбонатов кальция и магния, которые при кипячении выпадают в осадок в виде карбонатов:
Ca(HCO3)2 = CaCO3+H2O+CO2
Mg(HCO3)2 = MgCO3+H2O+CO2
При нагревании воды до 60 градусов эти реакции не происходят, и вода остается жесткой. Поэтому белье лучше отстирается у той хозяйки, которая прокипятила воду.
Следует помнить, что кипячением можно устранить только карбонатную, или временную, жесткость воды, а постоянная жесткость, обусловленная присутствием сульфатов и хлоридов кальция и магния, устраняется только действием соды:
СaSO4+Na2CO3=CaCO3+Na2SO4
MgSO4+Na2CO3=MgCO3+Na2SO4
Доказательство (используем датчик электропроводности ЦЛ Releon)
-
Наберем в химический стакан водопроводной воды. -
В две пробирки нальем по 2 мл водопроводной воды из химического стакана. -
Одну пробирку нагреем над спиртовкой до 60 0С, используя датчик температуры для замера температуры воды. Вторую – до кипения и прокипятим 5 минут. -
После остывания воды в пробирках, измерим электропроводность воды в пробирках.
В пробирке с прокипяченной водой электропроводность будет ниже, чем в пробирке в нагретой водой до 60 0С
Вывод: следовательно, моющее средство лучше будет отстирывать загрязнения с белья, в пробирке с прокипяченной горячей водой.
Задание 2.
Физиологический раствор – это растворы хлорида натрия, который применяется в случае потери организмом внеклеточной жидкости. Для приготовления берут дистиллированную воду и хлорид натрия.
Показан при состояниях, которые ведут к ограничению поступления жидкости:
-
диспепсия (нарушение нормальной деятельности ЖКТ) при отравлении; рвота, диарея; -
холера; -
обширные ожоги; -
гипонатриемия или гипохлоремия, при которых отмечается обезвоживание организма; -
для промывания ран, глаз, слизистой носовой полости.
В реанимацию попадают больные, потерявшие много крови. В этих случаях используют 0,9%-й раствор поваренной соли (ϸ= 1 г/мл), который близкий к солевому составу плазмы крови.
Представьте, что вы медсестра реанимационного отделения и должны срочно приготовить 500 мл такого раствора. Как вы на месте медсестры приготовили бы такой раствор? Объясните и докажите, что Вы получили 0,9%-ный раствор хлорида натрия.
Объяснение.
1. Необходимо приготовить 500мл 0,9%-ного физиологического раствора, плотностью ρ =1 г/мл. Значит масса заданного раствора - 500г (m=Vх ρ).
I способ. ωв-ва = (m в-ва / m р-ра) х 100% , отсюда
m в-ва = (ωв-ва х m р-ра ) /100%
m(NaCl) = (0,9 х 500) /100 = 4,5г
II cпособ. Массовая доля вещества показывает сколько граммов растворенного вещества содержится в 100г раствора. Поэтому масса хлорида натрия в 100г 0,9% -ного физиологического раствора составляет 0,9г.
В 100г физ. раствора содержится 0,9 г хлорида натрия
В 500 г физ. раствора содержится Х г хлорида натрия
Х= (500х0,9) /100= 4,5г = m(NaCl)
2. Необходимо взять 4,5 г хлорида натрия (поваренной соли) и добавить дистиллированной воды (или кипяченной) до массы 500г. Растворить и прокипятить 15 минут. Остудить до комнатной температуры.
Доказательство (используем датчик хлорид-ионов ЦЛ Releon)
Цифровой датчик концентрации хлорид-ионов показывает молярную концентрацию ионов.
Молярная концентрация показывает сколько моль растворенного вещества содержится в 1 раствора.
Переводим массовую долю (ω) в молярную концентрацию (С) по формуле
C = m в-ва / ( Mв-ва х V),
где
C — молярная концентрация, моль/л
m в-ва –масса растворенного вещества, г
M в-ва —
молярная масса растворенного вещества, г/моль
V – объем раствора, л
С= 4,5/ (58,5 х 0,5) = 0,154 моль/л
Измеряем молярную концентрацию хлорид-ионов в полученном растворе и сравниваем с расчетной.
Измерение (используем датчик хлорид-ионов ЦЛ Releon)
-
На штативе установлены две лапки:
-
в первой лапке закрепляем электрод хлорид-ионов; снимаем колпачок, промываем датчик дистиллированной водой и осушаем фильтровальной бумагой. Электрод подключить к датчику рН. -
во второй лапке закрепляем электрод сравнения.
Подключаем к универсальному датчику оба электрода.
-
Опускаем оба электрода в химический стакан так, чтобы электроды не касались стенок и дна стакана. -
Запускаем программу ЦЛ и датчик. Нажимаем «Пуск»
Задача 3.
Существенным фактором, влияющим на плодородие почвы, является кислотность(водородный показатель рН).
Огородные растения условно разделены на три группы – по способности развития на разных грунтах:
-
базифилы (pH7–7,5) -
нейтрофилы (pH6–7) -
ацидофтлы (pH5–6).
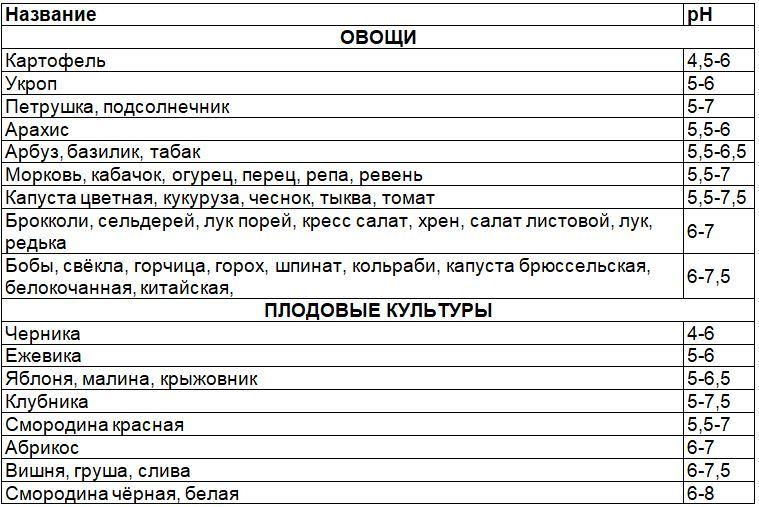
Измерьте кислотность выданного образца почвы и предложите какие культурные растения можно выращивать на участке с данной кислотностью почвы.
Измерение (используем датчик рН ЦЛ Releon)
-
В пробирку поместить почву (столбик 2-3 см). Прилить дистиллированную воду объёмом в 3 раза больше столбика почвы. Перемешать стеклянной палочкой полученную смесь. -
Профильтровать данную смесь через фильтр в колбу. Перед фильтрованием смесь не встряхивать. После фильтрации получился почвенный раствор. -
Электрод рН закрепить в лапке штатива, снять колпачок и промыть датчик дистиллированной водой и осушить фильтровальной бумагой. Электрод подключить к датчику рН. Датчик подключить к ноутбуку. -
Опустить электрод рН в почвенный раствор, чтобы он не касался стенок и дна колбы. -
Нажать «Пуск» и подождать установление показания в течение 30 сек. Зафиксировать показания.

