Файл: Методические указания к выполнению практических работ по по предмету металлургия редких металлов по направлениям бакалавриата.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 27
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
= 843 0,5 + 106 0,5 = 951,5 кг с2/м4;
n- число оборотов турбинки;
d – диаметр турбинки;
 - вязкость смеси фаз (
- вязкость смеси фаз (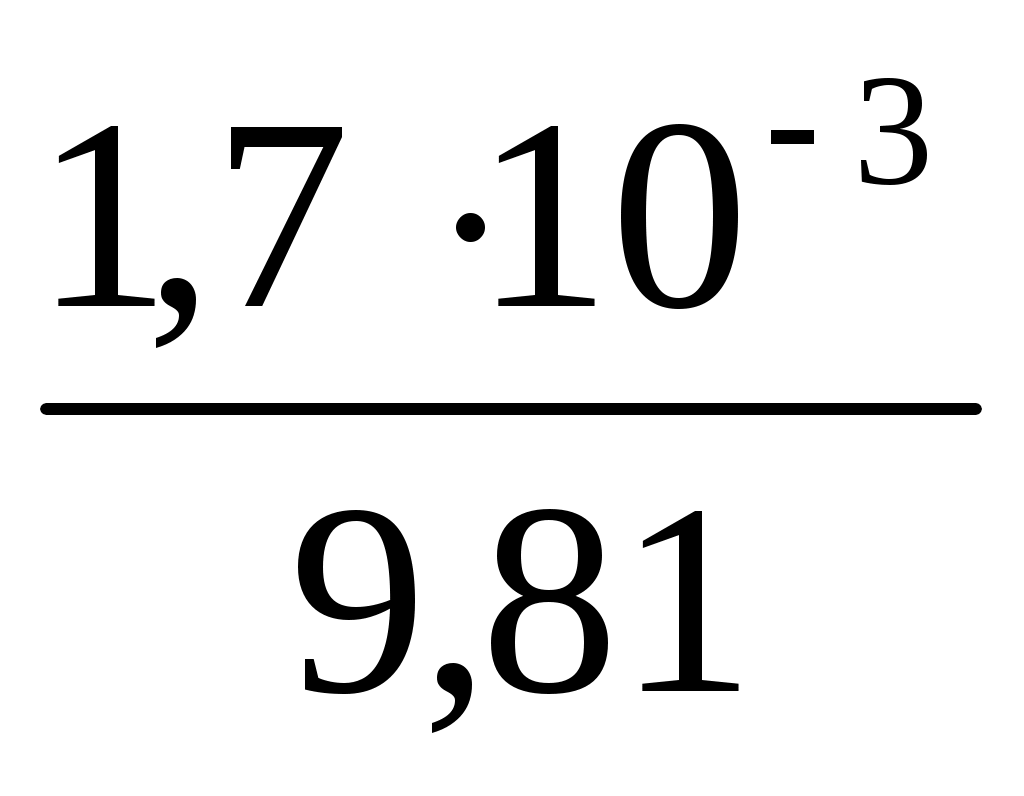 Па с = 1,73 10-4 Па с);
Па с = 1,73 10-4 Па с);
d = 0,3 l = 0.3 0.88 = 0.3m
Обычно n=100-300 об/мин; принимаем n = 250 об/мин или n = 4,17с-1.
Тогда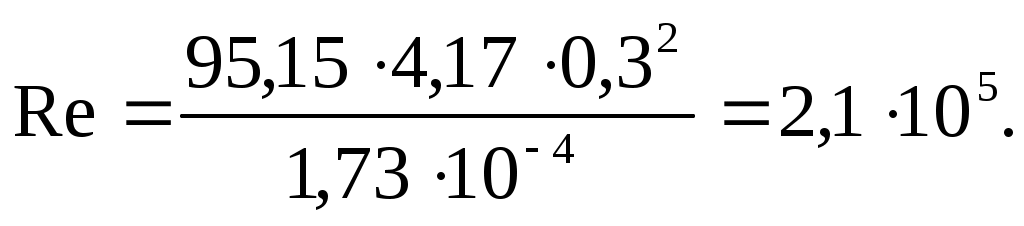
2. Критерий Эйлера:
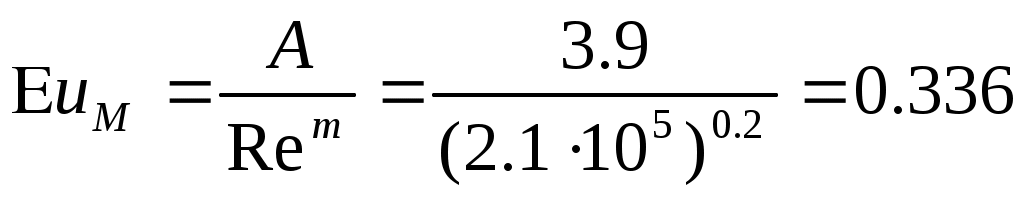 m = 0.2; (8.5)
m = 0.2; (8.5)
1. Рабочая мощность одной турбинки
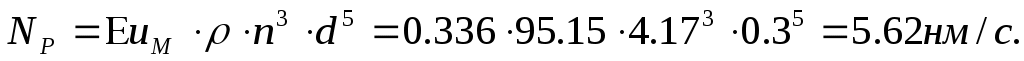 (8.6)
(8.6)
2. Мощность двигателя, приводящего во вращение 6 турбинок, с учетом двухкратного запаса на момент пуска и к.п.д. передачи ( = 0,8) равна
= 0,8) равна
NДВИГ =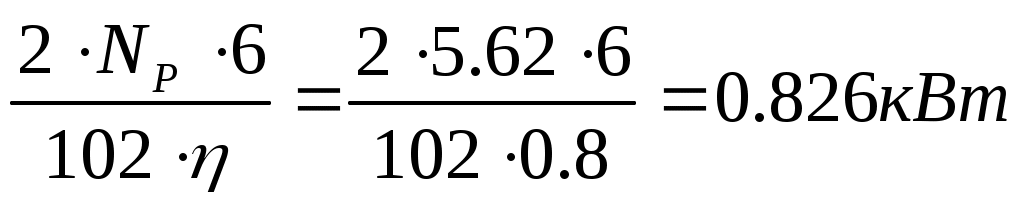 (8.6)
(8.6)
II. Смеситель – отстойник ящичного типа с пневматическим перемешиванием.
Такие аппараты используют тогда, когда мешалки нельзя ставить из - за агрессивности среды.
Жидкости движутся за счет перепада давлений между секциями.
1. Объем смесительной и отстойной камер определяют так же, как и в предыдущем случае.
2. Высота налива ННАЛ – уровень жидкости в отстойной камере связана с Vот и площадью отстойной камеры соотношением
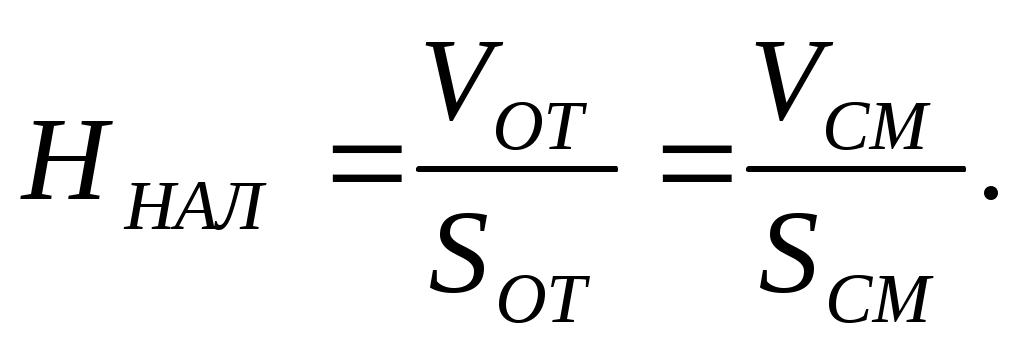 (8.7)
(8.7)
3. Обычно соотношение сторон смесительной камеры принимается 1:1. С точки зрения энергозатрат оптимальным является
1,5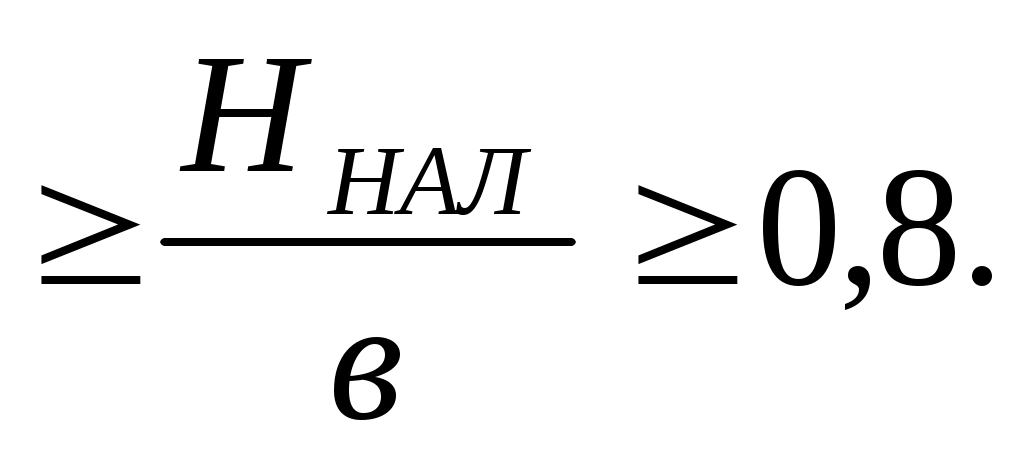 (8.8)
(8.8)
4. Длина отстойной камеры
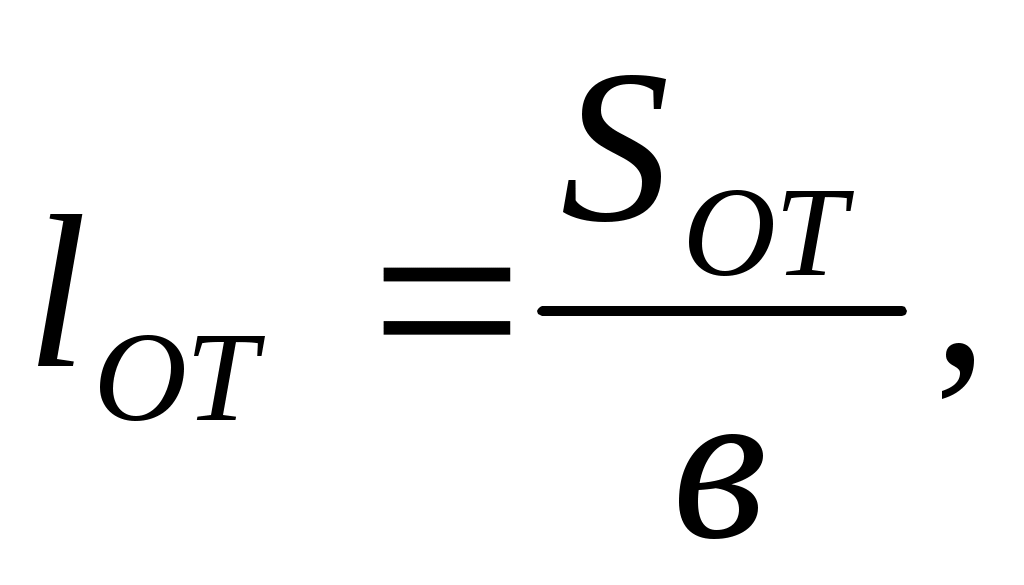 (8.9)
(8.9)
5. Длина предкамеры
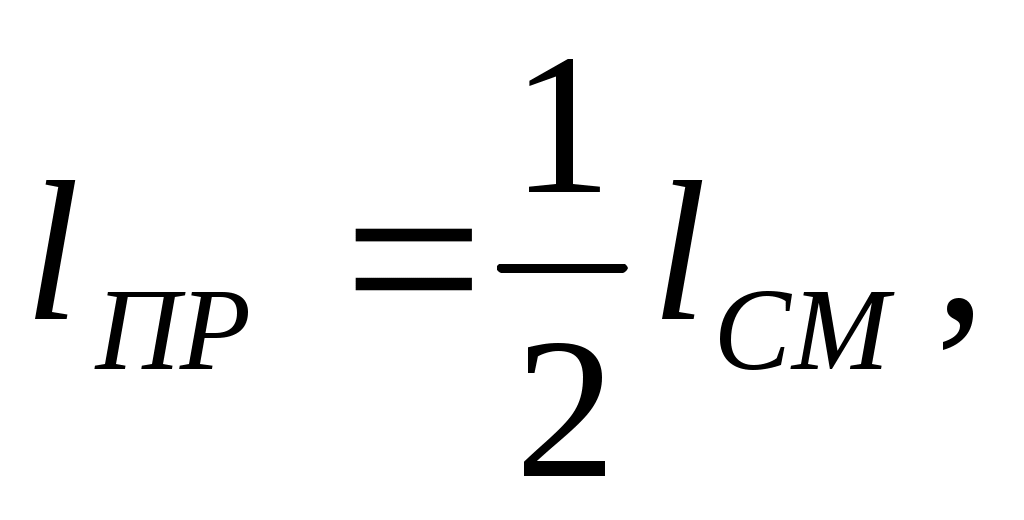 (8.10)
(8.10)
6. Тогда общая длина одной ячейки
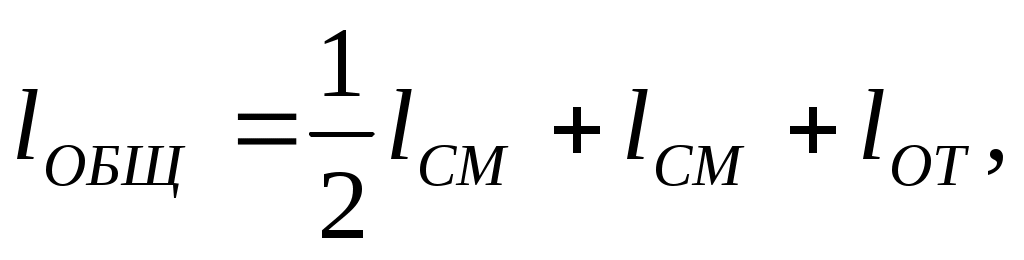 (8.11)
(8.11)
7. Общая высота НОБЩ находится из соотношения
ННАЛ = 0,8 НОБЩ. (8.12)
Задание: Произвести расчет основных показателей смеситель-отстойник ящичного типа.
Таблица 13.
Практическая работа №6. РАСЧЕТ ТРЕБУЕМОГО КОЛИЧЕСТВА ХИМИЧЕСКИХ РЕАГЕНТОВ В ПРОЦЕССЕ ДЕСОРБЦИИ УРАНА
Цель работы: Цель работы: Ознакомление студента с расчетами технологического отстойника продуктивных растворов.
В основе регенерации ионообменных материалов лежит химическая реакция обмена вытесняющих ионов и ионов, химически связанных с функциональными группами смолы. Поэтому во всех случаях, за исключением процесса десорбции, т.е. удаление необменно поглощенных ионитом веществ за счет физической адсорбции, имеет место химическая реакция с обязательным присутствием вытесняющих ионов. Эти ионы могут быть введены в процесс с различными химическими реагентами (азотной кислотой или серная кислота, аммиачная селитра и аммиачная вода). Такой тип регенерации называется реагентной регенерацией.
Химическая регенерация занимает основное место в ионообменной регенерации. Она позволяет получить любую необходимую степень регенерации, провести процесс регенерации в требуемом временном диапазоне, довести концентрацию извлекаемого иона в регенерате до нужного уровня.
Вещество, применяемое для десорбции урана, называется десорбентом, раствор, в который перешел уран из молекул ионита – десорбатом.
По типу применяемого десорбента различают сернокислотную и нитратную десорбцию. При сернокислотной десорбции реакция описывается уравнением:
(R4 N)4 [UO2 (SO4)3]4- + 2 SO4 2- → 2(R4 N)4SO4 2- + [UO2(SO4)3]4-
Обычно десорбцию проводят раствором серной кислоты 15- % концентрации.
Нитратный способ также относится к классу вытеснительных способов десорбции. В отличие от сернокислотного способа, после окончания десорбции урана нитратами требуется перевод анионита в рабочую ионную форму.
Химизм десорбции урана описывается следующими уравнениями реакций:
(R4N)2 [UO2(SO4)2] + 2NO3- → 2R4N – NO3 + [UO2(SO4)2]2-
(R4N)4 [UO2(SO4)3] + 4NO3- → 4R4N - NO3 + [UO2(SO4)3]4-.
Минимальный расход элюента (исходного раствора) достигается обычно при некоторой оптимальной концентрации.
Расчет требуемого количества химических реагентов в процессе десорбции урана: расхода азотной или серной кислоты, аммиачной селитры и аммиачной воды.
ХАРАКТЕРИСТИКА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
1. Состав десорбирующего раствора:
концентрация HNO3 – 30-50г/л;
концентрация NO3 - 70-110 г/л;
емкости смолы 35-45 кг/т по урану.
2. Объемное соотношение на регенерации смолы к раствору (десорбатом):
Vсм х Vр-р = 1: 2.
3. Количество маточников фильтрации равное количеству товарного регенерата, подаваемого на осаждение- 50-100л.
4. Количество маточников фильтрации, направляемых для пассивации (снижения активности сернокислых растворов на денитрации)- 25-50л.
5. Содержание нитратов в маточниках фильтрации-10-25г/л.
6. Объемное соотношение на денитрации смолы к раствору:
Vсм: Vр-р = 1: 0,9.
7.Концентрация урана в регенерате составляет 5-20 г/л.
1. Расчет азотной кислоты на 1кг урана.
Исходные данные:
1.Состав десорбирующего раствора:
концентрация HNO3 – 40 г/л
концентрация NO3 - 80 г/л
Для десорбции 1 кг урана при емкости смолы 40 кг/т по урану, количество смолы составит:
1,0: 40 кг/т = 0,025 т
0,025 т х 2,2 м3/т = 0,05м3
Объемное соотношение на регенерации смолы:
Vсм х Vр-р = 1: 2
Тогда количество десорбирующего раствора для cнятия 1 кг урана составит:
0,05 х 2 = 0,1 м3
Количество азотной кислоты при концентрации 40 г/л составит:
100 л х 40 г/л = 4000 г.
2. Расчет расхода аммиачной селитры на 1кг урана.
Для регламентного содержания NO3 – 80г/л в 96,8л десорбирующего раствора требуется:
96,8л х 80 г/л = 7744г NO3
2.1. Расчет количества NO3, поставляемое с азотной кислотой в десорбирующий раствор составит:
63 – 62
4000 – Х
Х=62х4000 /63 = 3936,5г NO3
где, 63 – молекулярный вес HNO3;
62 – молекулярный вес NO3;
2.2. Количество нитратов, возвращаемое в процесс приготовления десорбирующего раствора с маточниками фильтрации:
(50,0л – 25,0л) х 15,0 = 375,0 г NO3
где, 50,0л – количество маточников фильтрации подаваемого на осаждение;
25,0л – количество маточников фильтрации, направляемых для пассивации;
15,0г/л – содержание нитратов в маточниках фильтрации.
2.3. Количество нитратов , поступающих на приготовление десорбирующего раствора с растворами денитрации,
При соотношении Vсм: Vр-р = 1: 0,9, количество растворов денитрации составит::
50,0 х 0,9 = 45,0л, при содержании в них 55г/л нитратов, вовзврат нитратов составит:
45л х 55г/л = 2475 г
Суммарное количество NO3, возвращаемое с маточниками фильтрации и растворами денитрации составит:
2475г + 375 г= 2850г
2.5. Расчет необходимого добавочного количества NH4NO3 для десорбции 1кг урана:
7744- (3936,5 г + 2850г) = 957,5г NO3 , при пересчете на селитру это составит:
957,5 х 80 / 62 = 1235г NH4NO3.
Осаждение урана аммиачной водой происходит по уравнению:
UO2 + 2NH4 + 6OH = (NH4)2U2O7 x 3H2O
Молекулярный вес (NH4)2U2O7 x 3H2O = 678
Молекулярный вес (2NH4 + 6OH) = 138
Исходя из стехиометрического соотношения на образование 678 кг (NH4)2U2O7x3H2O необходимо затратить 138 кг аммиачной воды.
В 678 кг диураната аммония содержится 476 кг урана, то 1 кг урана содержится в 1,424 кг диураната из соотношения:
678 кг – 476 кг Х = 678 х 1: 476 = 1,424 кг
х кг - 1 кг
Расход аммиачной воды на осаждение 1,424 кг диураната составит:
138 кг – 678 кг Х = 1,424 х 138: 678 = 0,29 кг
х кг – 1,424 кг
Если концентрация урана в регенерате составляет 11 г/л, то для получения 1 кг урана необходимо:
1000 г: 11 г/л = 90,9 л регенерата
Концентрация HNO3 в регенерате составляет 40,0 г/л (4,0 %).
Содержание HNO3 в 90,9 л регенерата составит:
40,0 г/л х 90,9л = 3636 г или 3,636 кг
Для нейтрализации HNO3, исходя из уравнения реакции:
Задание: Произвести расчет требуемого количества химических реагентов в процессе десорбции урана.
Таблица 17.
n- число оборотов турбинки;
d – диаметр турбинки;
d = 0,3 l = 0.3 0.88 = 0.3m
Обычно n=100-300 об/мин; принимаем n = 250 об/мин или n = 4,17с-1.
Тогда
2. Критерий Эйлера:
1. Рабочая мощность одной турбинки
2. Мощность двигателя, приводящего во вращение 6 турбинок, с учетом двухкратного запаса на момент пуска и к.п.д. передачи (
NДВИГ =
II. Смеситель – отстойник ящичного типа с пневматическим перемешиванием.
Такие аппараты используют тогда, когда мешалки нельзя ставить из - за агрессивности среды.
Жидкости движутся за счет перепада давлений между секциями.
1. Объем смесительной и отстойной камер определяют так же, как и в предыдущем случае.
2. Высота налива ННАЛ – уровень жидкости в отстойной камере связана с Vот и площадью отстойной камеры соотношением
3. Обычно соотношение сторон смесительной камеры принимается 1:1. С точки зрения энергозатрат оптимальным является
1,5
4. Длина отстойной камеры
5. Длина предкамеры
6. Тогда общая длина одной ячейки
7. Общая высота НОБЩ находится из соотношения
ННАЛ = 0,8 НОБЩ. (8.12)
Задание: Произвести расчет основных показателей смеситель-отстойник ящичного типа.
Таблица 13.
-
№
n
QЛ
м3/сут
QТ
м3/сут

кПа с
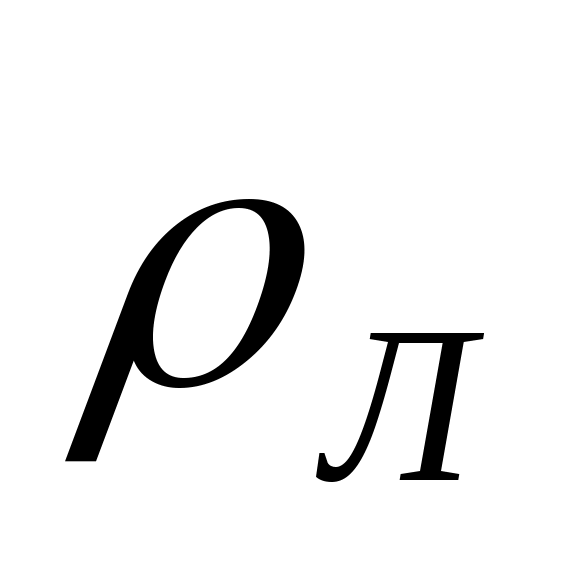
кг/м3
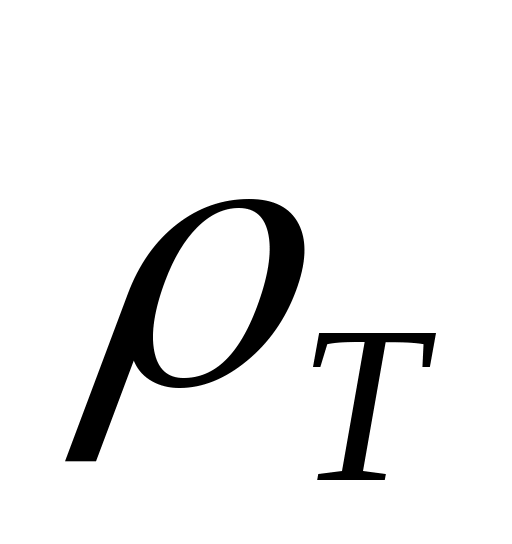
кг/м3
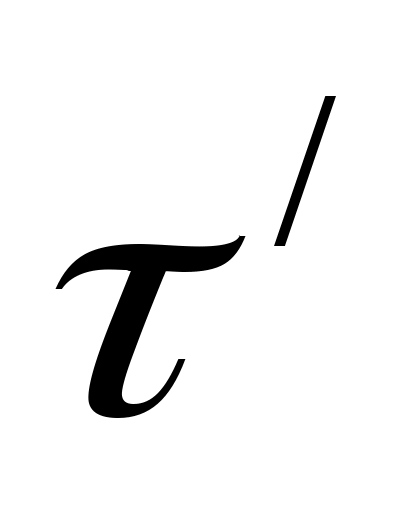
мин
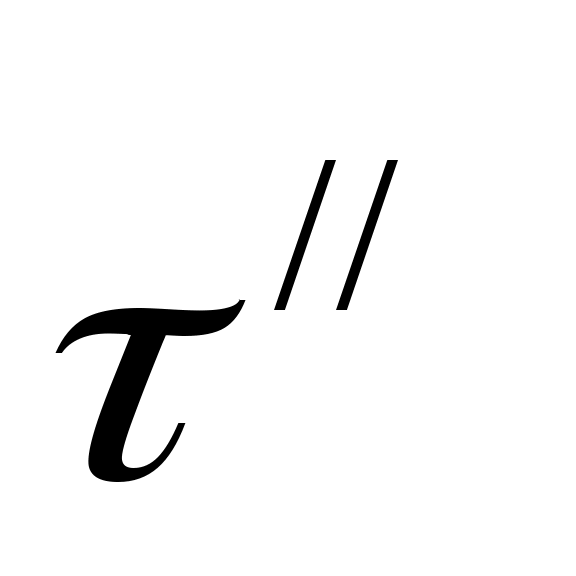
мин
1
7
270
250
1,72
844
1065
2,6
10
2
8
300
240
1,68
846
1070
2,8
11
3
10
310
260
1,74
852
1075
3,0
12
4
12
320
270
1,69
865
1080
3,2
12
5
14
340
280
1,71
890
1090
3,2
14
6
8
320
250
1,72
900
1100
3,0
12
7
10
310
270
1,68
910
1120
3,2
11
8
6
360
280
1,74
900
1140
3,1
13
9
12
380
310
1,69
850
1075
3,4
15
10
14
350
300
1,71
840
1060
3,2
13
Практическая работа №6. РАСЧЕТ ТРЕБУЕМОГО КОЛИЧЕСТВА ХИМИЧЕСКИХ РЕАГЕНТОВ В ПРОЦЕССЕ ДЕСОРБЦИИ УРАНА
Цель работы: Цель работы: Ознакомление студента с расчетами технологического отстойника продуктивных растворов.
В основе регенерации ионообменных материалов лежит химическая реакция обмена вытесняющих ионов и ионов, химически связанных с функциональными группами смолы. Поэтому во всех случаях, за исключением процесса десорбции, т.е. удаление необменно поглощенных ионитом веществ за счет физической адсорбции, имеет место химическая реакция с обязательным присутствием вытесняющих ионов. Эти ионы могут быть введены в процесс с различными химическими реагентами (азотной кислотой или серная кислота, аммиачная селитра и аммиачная вода). Такой тип регенерации называется реагентной регенерацией.
Химическая регенерация занимает основное место в ионообменной регенерации. Она позволяет получить любую необходимую степень регенерации, провести процесс регенерации в требуемом временном диапазоне, довести концентрацию извлекаемого иона в регенерате до нужного уровня.
Вещество, применяемое для десорбции урана, называется десорбентом, раствор, в который перешел уран из молекул ионита – десорбатом.
По типу применяемого десорбента различают сернокислотную и нитратную десорбцию. При сернокислотной десорбции реакция описывается уравнением:
(R4 N)4 [UO2 (SO4)3]4- + 2 SO4 2- → 2(R4 N)4SO4 2- + [UO2(SO4)3]4-
Обычно десорбцию проводят раствором серной кислоты 15- % концентрации.
Нитратный способ также относится к классу вытеснительных способов десорбции. В отличие от сернокислотного способа, после окончания десорбции урана нитратами требуется перевод анионита в рабочую ионную форму.
Химизм десорбции урана описывается следующими уравнениями реакций:
(R4N)2 [UO2(SO4)2] + 2NO3- → 2R4N – NO3 + [UO2(SO4)2]2-
(R4N)4 [UO2(SO4)3] + 4NO3- → 4R4N - NO3 + [UO2(SO4)3]4-.
Минимальный расход элюента (исходного раствора) достигается обычно при некоторой оптимальной концентрации.
Расчет требуемого количества химических реагентов в процессе десорбции урана: расхода азотной или серной кислоты, аммиачной селитры и аммиачной воды.
ХАРАКТЕРИСТИКА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
1. Состав десорбирующего раствора:
концентрация HNO3 – 30-50г/л;
концентрация NO3 - 70-110 г/л;
емкости смолы 35-45 кг/т по урану.
2. Объемное соотношение на регенерации смолы к раствору (десорбатом):
Vсм х Vр-р = 1: 2.
3. Количество маточников фильтрации равное количеству товарного регенерата, подаваемого на осаждение- 50-100л.
4. Количество маточников фильтрации, направляемых для пассивации (снижения активности сернокислых растворов на денитрации)- 25-50л.
5. Содержание нитратов в маточниках фильтрации-10-25г/л.
6. Объемное соотношение на денитрации смолы к раствору:
Vсм: Vр-р = 1: 0,9.
7.Концентрация урана в регенерате составляет 5-20 г/л.
Пример расчета удельной нормы расхода на 1 кг урана азотной кислоты, аммиачной селитры и аммиачной воды по схеме нитратной десорбции
1. Расчет азотной кислоты на 1кг урана.
Исходные данные:
1.Состав десорбирующего раствора:
концентрация HNO3 – 40 г/л
концентрация NO3 - 80 г/л
Для десорбции 1 кг урана при емкости смолы 40 кг/т по урану, количество смолы составит:
1,0: 40 кг/т = 0,025 т
0,025 т х 2,2 м3/т = 0,05м3
Объемное соотношение на регенерации смолы:
Vсм х Vр-р = 1: 2
Тогда количество десорбирующего раствора для cнятия 1 кг урана составит:
0,05 х 2 = 0,1 м3
Количество азотной кислоты при концентрации 40 г/л составит:
100 л х 40 г/л = 4000 г.
2. Расчет расхода аммиачной селитры на 1кг урана.
Для регламентного содержания NO3 – 80г/л в 96,8л десорбирующего раствора требуется:
96,8л х 80 г/л = 7744г NO3
2.1. Расчет количества NO3, поставляемое с азотной кислотой в десорбирующий раствор составит:
63 – 62
4000 – Х
Х=62х4000 /63 = 3936,5г NO3
где, 63 – молекулярный вес HNO3;
62 – молекулярный вес NO3;
2.2. Количество нитратов, возвращаемое в процесс приготовления десорбирующего раствора с маточниками фильтрации:
(50,0л – 25,0л) х 15,0 = 375,0 г NO3
где, 50,0л – количество маточников фильтрации подаваемого на осаждение;
25,0л – количество маточников фильтрации, направляемых для пассивации;
15,0г/л – содержание нитратов в маточниках фильтрации.
2.3. Количество нитратов , поступающих на приготовление десорбирующего раствора с растворами денитрации,
При соотношении Vсм: Vр-р = 1: 0,9, количество растворов денитрации составит::
50,0 х 0,9 = 45,0л, при содержании в них 55г/л нитратов, вовзврат нитратов составит:
45л х 55г/л = 2475 г
Суммарное количество NO3, возвращаемое с маточниками фильтрации и растворами денитрации составит:
2475г + 375 г= 2850г
2.5. Расчет необходимого добавочного количества NH4NO3 для десорбции 1кг урана:
7744- (3936,5 г + 2850г) = 957,5г NO3 , при пересчете на селитру это составит:
957,5 х 80 / 62 = 1235г NH4NO3.
3.Расчет расхода аммиачной воды на 1 кг урана.
Осаждение урана аммиачной водой происходит по уравнению:
UO2 + 2NH4 + 6OH = (NH4)2U2O7 x 3H2O
Молекулярный вес (NH4)2U2O7 x 3H2O = 678
Молекулярный вес (2NH4 + 6OH) = 138
Исходя из стехиометрического соотношения на образование 678 кг (NH4)2U2O7x3H2O необходимо затратить 138 кг аммиачной воды.
В 678 кг диураната аммония содержится 476 кг урана, то 1 кг урана содержится в 1,424 кг диураната из соотношения:
678 кг – 476 кг Х = 678 х 1: 476 = 1,424 кг
х кг - 1 кг
Расход аммиачной воды на осаждение 1,424 кг диураната составит:
138 кг – 678 кг Х = 1,424 х 138: 678 = 0,29 кг
х кг – 1,424 кг
Если концентрация урана в регенерате составляет 11 г/л, то для получения 1 кг урана необходимо:
1000 г: 11 г/л = 90,9 л регенерата
Концентрация HNO3 в регенерате составляет 40,0 г/л (4,0 %).
Содержание HNO3 в 90,9 л регенерата составит:
40,0 г/л х 90,9л = 3636 г или 3,636 кг
Для нейтрализации HNO3, исходя из уравнения реакции:
HNO3 + NH4OH = NH4NO3 + H2O, по стехиометрическим коэффицентам понадобится аммиачной воды:
35 – 63 Х = 35 х 3,636/ 63=2,0 кг
Х – 3,636
где 63 – молекулярный вес азотной кислоты
35 – молекулярный вес аммиачной воды
Суммарный расход составит 0,289кг + 2,0кг = 2,289кг NH4OH.
Задание: Произвести расчет требуемого количества химических реагентов в процессе десорбции урана.
Таблица 17.
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| КНNO, г/л | 35 | 50 | 40 | 30 | 35 | 45 | 30 | 40 | 50 | 40 |
| KNO, г/л | 90 | 110 | 80 | 70 | 85 | 100 | 75 | 95 | 105 | 85 |
| Eсмолы, кг/т | 35 | 45 | 35 | 35 | 40 | 40 | 35 | 45 | 45 | 40 |
| QМ.Ф осажд, литр. | 50 | 70 | 60 | 50 | 55 | 85 | 50 | 80 | 90 | 85 |
| QМ.Ф пасс, литр. | 25 | 40 | 25 | 30 | 35 | 50 | 25 | 35 | 45 | 35 |
| СNO, г/л. МАТОЧ/ФИЛ | 15 | 20 | 15 | 20 | 15 | 20 | 15 | 20 | 15 | 20 |
| VCM/VP-P регенерации | 1:2 | 1:1,8 | 1:2 | 1:1,7 | 1:1,8 | 1:2 | 1:2 | 1:1,8 | 1:1,7 | 1:2 |
| VCM/VP-P денитрации | 1:0,8 | 1:0,9 | 1:0,85 | 1:0,9 | 1:0,8 | 1:0,9 | 1:0,85 | 1:0,9 | 1:0,9 | 1:0,8 |

