Файл: Методические указания к выполнению практических работ по по предмету металлургия редких металлов по направлениям бакалавриата.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.02.2024
Просмотров: 29
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Практическая работа № 3.
РАСЧЕТ ОБЖИГА МОЛИБДЕНОВОГО КОНЦЕНТРАТА
Цель работы: Определение рационального состава фаз, взаимодействие, и приобретение навыков по расчету.
Расчет процесса обжига
При окислительном обжиге промпродукта в интервале температур 400-5000С молибденит взаимодействует с кислородом с образованием МоО3 минуя стадию образования двуокиси молибдена. Примеси сульфидных минералов меди, железа, цинка превращаются в окислы, частично в сульфаты. Окислы, сульфаты и карбонаты названных элементов в интервале температур 500-7000С активно реагируют с МоО3, образуя молибдаты.
Состав огарка рассчитывается следующим образом: дисульфид молибдена при температурах выше 5000С интенсивно взаимодействует с кислородом по суммарной реакции:
MoS2+3½O2→MoO3+2SO2.
При обжиге в печах КС степень окисления молибденита превышает 95 %. Примем степень окисления молибденита 97 %, тогда:
97% 3%
MoS2 + 3½O2 → (MoO3 + MoS2) + 2SO2
35 0,97 = 33,95 кг Мо окисляется до МоО3,
35 0,03 = 1,05 кг Мо недоокисленного в форме МоS2.
33,95 кг Мо – 66,6 %
х – 100 %
х =
51 - 5,8 – 0,53 – 1,152 – 1 = 42,518
В МоS2 - 60 % и 40 % S2
1,05 кг Мо – 60 %
х – 100 %
х =
В 58,3 кг MoS2, сера 23,3 кг
23,3 – 0,7 = 22,6 кг сера в SО2
В SО2 50 % S2 и 50 % О2.
(22,6 100) : 50 = 45,2 кг SО2
2) Примем степень окисления СuS 90 %.
90 % 10 %
СuS + 1,5О2 → (СuO + CuS) + 2SO2
4,8 кг 0,9 = 4,32 кг Cu окисляется до СuO
В СuO 79,8 % Сu и 20,2 % О2
4,32 кг Cu – 79,8 %
х – 100 %
х =
4,8 0,1 = 0,48 кг Сu недоокисляется и останется в форме СuS. В СuS 66,4 % Сu и 33,6 % S2.
0,48 кг Cu – 66,4 %
х – 100 %
х =
В 7,3 кг СuS серы – 2,5 кг
2,5 - 0,22 – 2,28 кг серы в SO2 (50 : 50).
(2,28 100) : 50 = 4,56 кг SO2.
→ СuMoO4.
СuO вступает в реакцию с MoO3 в интервале температур 300-7000С. Так как в многоподовой печи температура не должна перевыщать 5900С, то примем, что из всего СuO с MoO3 вступает в реакцию 60 % СuO.
5,4 кг СuO – 100 %
х кг СuO – 60 %
х =
79,5 кг СuO – 144 кг MoO3
3,24 кг СuO – х % MoO3
х =
СuMoO4 = 3,24 + 5,8 = 9,04 кг.
3) Принимаем степень окисления FeS2 90 %.
90 % 10 %
4FeS2 + 11O2 → 2(Fe2O3 + FeS2) + 8SO2.
5,7 0,9 = 5,13 кг Fe окисляется до Fe2O3.
В Fe2O3 70 % Fe и 30 % O2.
5,13 кг Fe – 70 %
х кг – 100 %
х =
5,7 0,1 = 0,57 кг Fe недоокисляется и остается в форме FeS2.
В FeS2 46,6 % Fe и 53,4 % S2.
0,57 кг Fe – 46,6 %
х кг – 100 %
х =
В 12,32 кг FeS2 серы 6,62 кг.
6,62- 0,65 = 5,97 S2 в SО2
(5,97 100) : 50 = 11,94 кг SО2
Fe2О3 + 3МоO3 → Fe2(МоО4)3.
Это реакция протекает при температуре выше 6000С, а эта температура не допустима в многоподовой печи. И поэтому примем, что реакция не будет протекать.
4) Принимаем степень окисления ZnS 90 %.
90 % 10 %
ZnS + 1,5O2 → 2(ZnO + ZnS) + SO2.
0,68 0,9 = 0,612 кг Zn окисляется до ZnO.
В ZnO 80,3 % Zn и 19,7 % O2.
0,612 кг Zn – 80,3 %
х кг – 100 %
х =
0,68 0,1 = 0,068 кг Zn остается в форме ZnS.
В ZnS 6,7 % Zn и 33 % S2.
0,068 кг Zn – 67 %
х кг – 100 %
х =
В 1,02 кг ZnS серы 0,34 кг.
0,34- 0,032 = 0,308 кг S2 в SО2, т.е. (50:50).
(0,308 100) : 50 = 0,616 кг SО2
Это реакция интенсивно протекает в интервале температур 600-7000С. реакция наблюдается при температуре ниже 4000С. так как максимальная температура печи 5900С, примем, что из этого ZnО в реакцию вступает 40 % ZnО.
ZnО + МоO3 → ZnМоО4.
0,762 кг ZnО – 100 %
х кг – 40 %
х =
0,762 – 0,3 = 0,462 кг ZnO.
81,3 кг ZnО – 144 кг МоО3
0,3 кг ZnO – х кг МоО3
х =
ZnМоО4 → 0,3 + 0,53 = 0,83 кг.
5)
100 кг СаСO3 – 56 кг СаО
4 кг СаСO3 – х кг СаО
х =
100 кг СаСO3 – 44 кг СO2
4 кг СаСO3 – х кг СO2
х =
Эта реакция начинает протекать при температуре выше 5000С. Примем, что в реакцию вступит 20 % СаО.
2,24 кг СаO – 100 %
х кг – 20 %
х =
56 кг СаO – 144 кг МоO3
0,448 кг СаO – х кг МоO3
х =
СаМоО4 = 0,448 + 1,152 = 1,6 кг.
6)
84,3 кг MgСO3 – 40,3 кг MgО
5,9 кг MgСO3 – х кг MgО
х =
84,3 кг MgСO3 – 44 кг СO2
5,9 кг MgСO3 – х кг СO2
х =
MgО реагирует с МоО3 при температуре 500-7000С. Примем, что в реакцию вступит 10 % MgО.
2,8 кг MgO – 100 %
х кг – 10 %
х =
2,8 – 0,28 = 2,52 кг MgО
40,3 кг MgO – 144 кг МоO3
0,28 кг MgO – х кг МоO3
х =
MgМоО4 = 0,28 + 1 = 1,28 кг.
7) Кремнезем в реакцию в МоО3 не вступает.
Результаты расчета сводим в табл. 2.
Таблица 2.
Химический состав огарка
| Соединение | Состав | Всего | |||||||||||
| Мо | Cu | Fe | Zn | S2 | O2 | Ca | Mg | P | As | SiO2 | кг | % | |
| МоО3 | 28,32 | | | | | 14,198 | | | | | | 42,518 | 51 |
| MoS2 | 1,05 | | | | 0,72 | | | | | | | 1,75 | 2,1 |
| CuS | | 0,48 | | | 0,22 | | | | | | | 0,7 | 0,84 |
| CuO | | 1,72 | | | | 0,44 | | | | | | 2,16 | 2,6 |
| CuMoO4 | 3,81 | 2,6 | | | | 2,63 | | | | | | 9,04 | 10,85 |
| FeS2 | | | 0,57 | | 0,65 | | | | | | | 1,22 | 1,46 |
| Fe2O3 | | | 5,13 | | | 2,19 | | | | | | 7,32 | 8,8 |
| ZnO | | | | 0,372 | | 0,09 | | | | | | 0,462 | 0,55 |
| ZnS | | | | 0,068 | 0,032 | | | | | | | 0,1 | 0,12 |
| ZnMoO4 | 0,35 | | | 0,24 | | 0,24 | | | | | | 0,83 | 1 |
| CaO | | | | | | 0,602 | 1,19 | | | | | 1,792 | 2,15 |
| CaMoO4 | 0,77 | | | | | 0,53 | 0,3 | | | | | 1,6 | 2 |
| MgO | | | | | | 0,98 | | 1,54 | | | | 2,52 | 3,02 |
| MgMoO4 | 0,7 | | | | | 0,42 | | 0,16 | | | | 1,28 | 1,53 |
| SiO2 | | | | | | | | | | | 9,4 | 9,4 | 11,29 |
| Ca3(PO4)2 | | | | | | 0,24 | 0,2 | | 0,11 | | | 0.55 | 0,66 |
| Ca3(AsO4)2 | | | | | | 0,01 | 0,01 | | | 0,01 | | 0,03 | 0,03 |
| Всего | 35 | 4,8 | 5,7 | 0,68 | 1,602 | 22,57 | 1,7 | 1,7 | 0,11 | 0,01 | 9,4 | 83,272 | 100 |
Практическая работа №5.
ГИДРОМЕТАЛЛУРГИЧЕСКОГО ПРОЦЕССА ПЕРЕДЕЛА УРАНОВОГО КОНЦЕНТРАТА
I. Расчет экстрактора.
Цель работы: Ознакомление студента процессами протекающими в экстракторе и технико-технологической характеристикой оборудования.
Характеристика процесса
Основной задачей экстракционного передела является очистка урана от примесей и максимальное его концентрирование. Для очистки урана от примесей применяется многоступенчатая экстракция с последующей реэкстракцией органической фазы раствором карбоната и бикарбоната аммония. Различают:
-
Простое физическое распределение. К этой группе относится сравнительно редкие случаи, когда экстракция не сопровождается химические взаимодействием. В данном случае экстрагируются химические соединения, растворимость которых в органическом растворителе на порядок выше, чем в воде. Соединения металлов по этому механизму не экстрагируются. -
Катионообменная экстракция. Это экстракция катионов металла органическими кислотами. Механизм экстракции состоит в обмене экстрагируемого металла на катион экстрагента. Ди-2-этилгексилфосфорная кислота (Д2ЭГФК) – органическая производная ортофосфорной кислоты. -
Анионообменная экстракция. Это экстракция анионов металла органическими кислотами. Три-н-актиламин (ТАА) – третичный амин, соль амина. -
Экстракция нейтральными экстрагентами. Используются нейтральные фосфорорганические соединения: трибутилфосфат (ТБФ).
Химизм процесса экстракции:
Д2ЭГФК: 2NH4R2PO4 + H2SO4 = (NH4)2SO4 + 2HR2PO4
UO2SO4 + 2HR2PO4 = UO2(R2PO4)2 + H2SO4
ТАА: R3N + H2SO4 = (R3NH)2SO4
UO2SO4 + H2SO4 = H2[UO2(SO4)2]
[UO2(SO4)2]2- + (R3NH)2SO4 = (R3NH)2[UO2(SO4)2] + H2SO4
ТБФ: 2(C4H9O)3PO + UO2SO4 = UO2SO4[(C4H9O)3PO]2
Наиболее распространенный ступенчатый экстрактор с механическим перемешиванием – смеситель – отстойник. Аппарат целесообразно применять при большом числе ступеней экстракции, реэкстракции и промывки, больших соотношениях потоков фаз (10-20:1). Они устойчиво работают даже при небольшом количестве твердых взвесей в фазах. Водная фаза засасывается снизу в турбину в смесительную камеру, в которую поступает органическая фаза. Так как равновесие между фазами устанавливается быстро (1-3 мин), а расслаивание за счет разности плотностей идет медленно (5 -15 мин), объем отстойника в 3 – 5 раз превышает объем смесительной камеры.
Смеситель-отстойник ящичного типа с перемешиванием.
Расчет основных размеров:
Исходные данные:
Число реальных ступеней n = 6-15
Расход легкой фазы QЛ = 250м3/сут;
Расход тяжелой фазы QТ = 250м3/сут;
(QЛ и QТ выбирают из баланса или задают в соответствии со значением
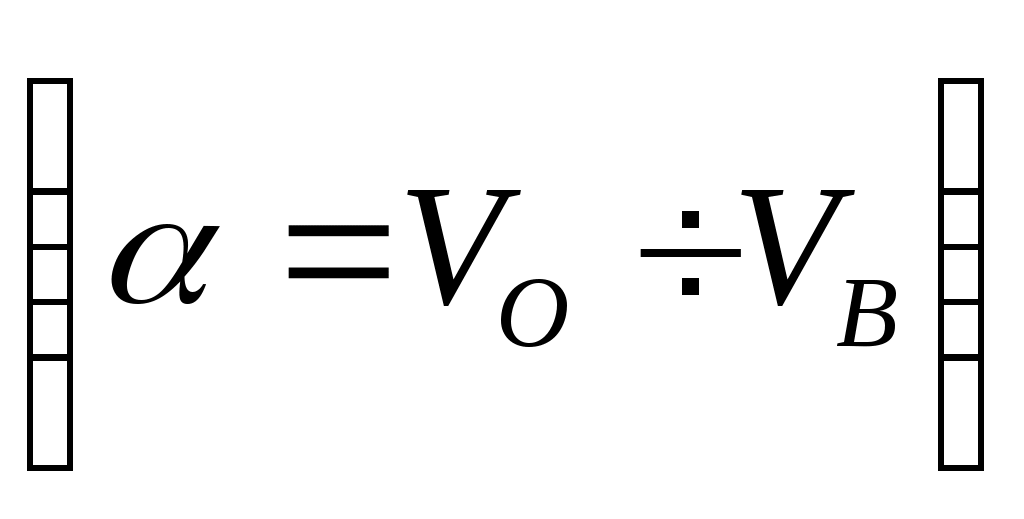 );
);Вязкость смеси фаз
Плотность легкой фазы
Плотность тяжелой фазы
Длительность смешивания
Длительность расслаивания
1. Объем смесительной камеры
Принимаем VСМ = 1м3 (коэффиц иент заполнения 0,88).
2. Объем отстойной камеры
Принимаем VОТ = 4м3 (коэффициент заполнения 0,88).
3. Объем аппарата из 6 ступеней
V=(VСМ + VОТ) n = 30м3. (8.3)
4. Соотношение смесительной камеры принимаем l:b:h = 1:1:1.5
Тогда при VСМ = 1м3 l:b:h = 0,88:0,88:1,3м
5. Соотношение размеров отстойной камеры принимаем:
L:B:H = 2.8:1:2;
Тогда при VОТ = 4м3 L:B:H = 2,55:0,88:1,76м.
Расчет мощности двигателя для вращения турбин.
Критерий Рейнольдса
где,

